Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Separácia proteínov - ionomeničová chromatografia. [cit. 2024-04-19]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/ionomenicova-chromatografia>.
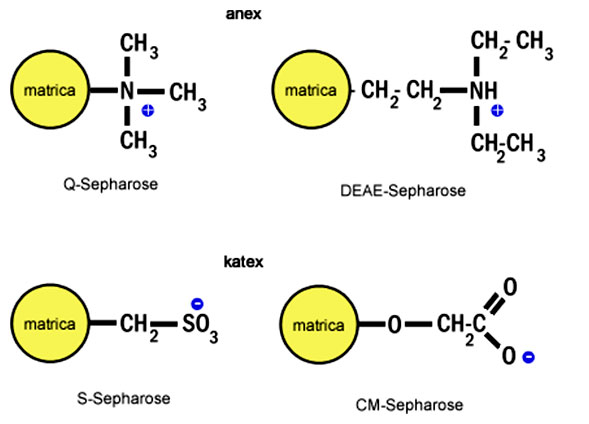
Pomocou tejto techniky dochádza k separácii proteínov na základe ich povrchového náboja. Matricu tvoria polysacharidové guličky (najčastejšia z agarózy alebo celulózy) s kovalentne naviazaným ligandom, ktorý nesie buď kladný (angl. anion-exchange, anex = viaže anióny) alebo záporný (angl. cation-exchange, katex = viaže katióny) náboj. Nosičom kladného náboja je napr. dietyl-aminoetyl (DEAE) skupina, nosičom záporného náboja je karboxymetyl (CM) skupina.
Počas chromatografickej separácie dochádza k "zbrzdeniu" proteínov na základe vratnej (reverzibilnej) elektrostatickej interakcie medzi povrchom proteínu a matricou. Kladne nabité proteíny interagujú so záporne nabitou matricou, takže sú z kolóny vytesnené (eluované) najneskôr. Naproti tomu, proteíny s prevahou záporného náboja prechádzajú záporne nabitou matricou veľmi rýchlo. V prípade kladne nabitej matrice je princíp ten istý, ale z hľadiska časovej elúcie jednotlivých proteínov presne opačný. Elúciu tých proteínov, ktoré sa na matricu naviazali, zabezpečuje postupná zmena koncentrácie soli (NaCl), čím sa mení iónová sila roztoku (v prípade katexu ide o kompetitívne vytesnenie proteínov z matrice katiónmi Na+, v prípade anexu aniónmi Cl-).
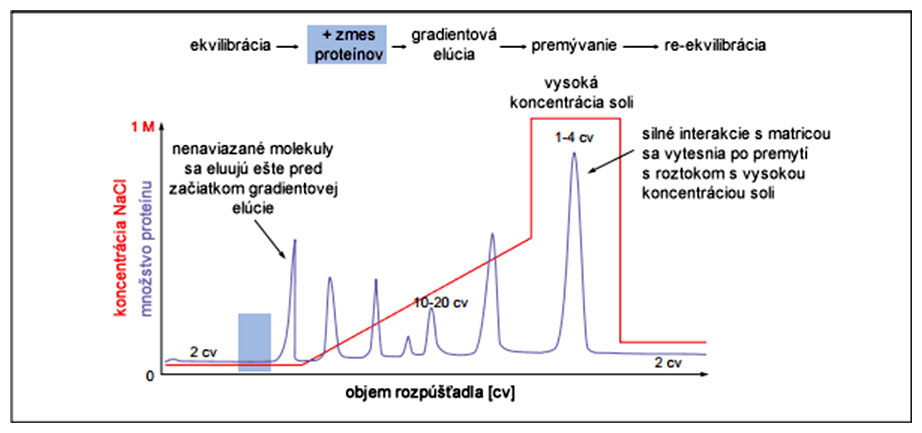
Po ekvilibrácii kolóny a nanesení zmesi proteínu na chromatografickú kolónu nemusí dôjsť k naviazaniu všetkých proteínov na matricu (napr. neutrálne a záporne nabité proteíny sa nemôžu naviazať na záporne nabitú matricu). Tieto proteíny sú eluované pomocou tlmivého roztoku ešte pred začiatkom gradientovej elúcie s roztokom NaCl. V ďalšom kroku začíname postupne pridávať roztok NaCl so stúpajúcou koncentráciou. Stane sa to, že v závislosti od sily iónovej interakcie proteínu k matrici, dochádza k postupnému kompetitívnemu nahrádzaniu proteínov katiónom Na+ (katex), resp. aniónom Cl- (anex). Proteíny s najväčšou interakciou k matrici sú vytesnené až po premývaní vysoko-koncentrovaným roztokom NaCl. Po skončení separácie je potrebné matricu znovu ekvilibrovať roztokom bez NaCl, aby nedošlo k poškodeniu matrice.
Proteín z matrice možno eluovať aj pomocou zmeny pH mobilnej fázy, pretože interakcia proteínu s matricou závisí aj od jeho izoelektrického bodu (pI). Každý proteín sa skladá z kladne (lyzín, arginín, histidín) a záporne nabitých aminokyselín (kyselina asparágová, kyselina glutámová), ktorých súčet vytvára celkový povrchový náboj proteínu (angl. net charge). V závislosti od okolitého pH vodného roztoku, tvoria skupiny týchto aminokyselín ióny. Izoelektrický bod je taká hodnota pH vodného roztoku, kedy je súčet kladných a záporných iónov proteínu v tomto roztoku rovný 0, a teda povrch proteínu je bez elektrického náboja. Pre každý proteín je hodnota pI iná, ale na základe aminokyselinového zloženia sa dá vypočítať.
Ak máme proteín s prevahou kladne nabitých aminokyselín, najskôr použijeme na jeho purifikáciu matricu so záporne nabitým ligandom. Ligand je však tak isto chemická zlúčenina, ktorá v závislosti od pH mobilnej fázy je elektricky nabitá (disociuje na ióny) alebo je elektricky neutrálna (vtedy neviaže žiadne molekuly). Ak chceme proteín viazať na túto matricu, musí sa pH mobilnej fázy nachádzať medzi hodnotou pH zabezpečujúcou disociáciu charakteristickej skupiny ligandu (tzv. disociačná konštanta) a medzi izoelektrickým bodom proteínu.
| disociačná konštanta matrice | izoelektrický bod proteínu | pH mobilnej fázy | |
| katex | 1,2 | 8,2 | 6,0 |
| anex | 10,3 | 6,8 | 8,0 |
V závislosti od spektra pH matríc, kedy dochádza k ich disociácii na ióny, rozlišujeme slabé (malý rozsah pH) a silné katexy/anexy. Pri väčšine purifikačných postupov je spočiatku vhodné začať s matricou, ktorá je nabitá počas celého spektra zmeny pH (najčastejšie 2-12). Nazýva sa silný katex (napr. S-Sepharose) alebo silný anex (napr. Q-Sepharose). Naproti tomu, DEAE je nabitá pri pH 5-9 (slabý anex), karboxymetyl-skupina rovnako pri pH 5-9 (slabý katex). Z toho vyplýva, že pH, ktoré je mimo tejto škály, neumožňuje väzbu proteínov k matrici. Inak povedané, všetky proteíny, ktorých izoelektrický bod je posunutý nad alebo pod uvedené pH (v závislosti od katexu alebo anexu), nie je nikdy možné na danú matricu naviazať, a budú eluované ešte pred začiatkom gradientu. To vytvára väčšiu selekciu na celé spektrum proteínov v proteínovej zmesi.
| typ matrice | funkčná skupina | výrobný názov | rozsah pH | iónová kapacita [Cl-/ml] |
| slabý katex | CM | CM Cellulose Sepharose | 5 - 9 | 0,09 - 0,13 |
| silný katex | sulfopropyl | SP Fast Flow Sepharose | 6 - 10 | 0,18 - 0,25 |
| slabý anex | DEAE | DEAE Cellulose Sepharose | 5 - 9 | 0,11 - 0,16 |
| silný anex | kvartérny amín | Q-Sepharose | 2 - 9 | 0,18 - 0,25 |
Zdroj: Guide to Ion-Exchange Chromatography. Harvard Apparatus
Ionomeničovú chromatografiu možno využiť aj na purifikáciu proteínu z komplexnej proteínovej zmesi. Výhodou je taktiež vysoká kapacita (až do 100 mg proteínu / 1 ml matrice) ako aj množstvo vzorky, ktoré môže byť naraz separované na kolóne (až 20% objemu, v porovnaní s 1% objemom pri gélovej filtrácii). Metóda je vhodná aj na zakoncentrovanie proteínu, ako aj odstránenie nukleových kyselín a endotoxínu. Oveľa častejšie sa používa anex, pretože väčšina proteínov sa za fyziologického pH (7-8) neviaže na katex. Katex však môže byť prvým purifikačným krokom separácie proteínov, exprimovaných za kyslých podmienok, ako napr. v kvasinke Pichia pastoris.