Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Molekulárne motory. [cit. 2024-04-19]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/molekularne-motory>.
Molekulárne motory patria k najfascinujúcejším bielkovinám. Predstavujú drobné biologické "stroje", ktoré zabezpečujú pohyb v živých organizmoch na molekulárnej úrovni. Spoločnou črtou molekulárnych motorov a tých, ktoré poznáme z techniky, je premena jednej formy energie na mechanickú prácu. V prípade molekulárnych motorov je týmto "pohonom" najčastejšie opakované enzymatické štiepenie - hydrolýza - molekúl s makroergickými väzbami (napr. adenozíntrifosfátu - ATP) alebo protónový gradient (gradient vodíkových katiónov, H+).
Pohyb molekulárnych motorov v bunke nie je chaotický, ale je viazaný na súčasti bunkového cytoskeletu (aktín alebo mikrotubuly), ktoré mu vytvárajú sieť podobne ako cesta pre autá. V jednej eukaryotickej bunke existuje viacero rôznych molekulárnych motorov, ktoré sa odlišujú v smere, akým sa po "ceste" pohybujú, a v type "tovaru", aký prevážajú. Mnohé molekulárne motory pohybujú vezikulami (napr. sekrečnými vezikulami Golgiho aparátu) alebo dokonca celými bunkovými organelami (napr. mitochondriami). Niektoré sa zúčastňujú bunkového delenia, pohybu riasiniek a bičíkov, svalovej kontrakcie a pod. V neposlednom rade existuje skupina špeciálnych rotujúcich molekulárnych motorov alebo proteínov, ktoré vykazujú len niektoré z vlastností molekulárnych motorov.
Cytoskeletárne molekulárne motory link
Sem zaraďujeme typické molekulárne motory asociované s cytoskeletom, ktoré majú veľmi podobnú štruktúru. Medzi najdôležitejšie z nich patria:
- myozíny
- kinezíny
- dyneíny
Myozíny link
Prvým identifikovaným proteínom tejto skupiny bol myozín. Myozín skôr poznáme ako typ mikrofilamentov (popri aktínu), ale zároveň je to aj významný molekulárny motor, ktorý je zodpovedný za silu svalovej kontrakcie.
Myozín patrí k jedným z najviac zastúpeným proteínom v ľudskom tele. Okrem svalov sa nachádza v ušiach, očiach a krvných doštičkách.
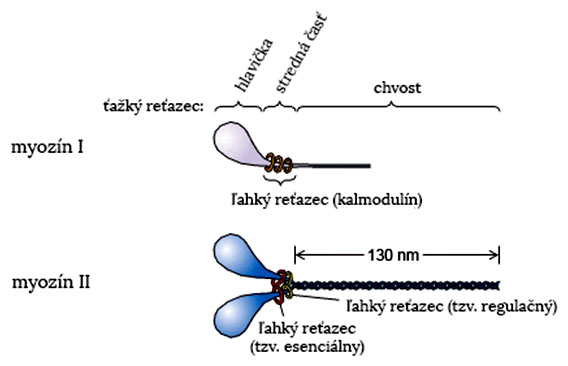
Myozín je dlhý tyčinkovitý proteín. Skladá sa z ťažkého reťazca a niekoľkých ľahkých reťazcov. Ťažký reťazec sa skladá z troch štruktúrne a funkčne odlišných domén:
- hlavička (N-terminus) je asociovaná s cytoskeletom (aktínom) a zároveň zabezpečuje väzbu s ATP a jeho hydrolýzu,
- stredná časť, ktorá prepája N- a C-koncovú časť a zároveň funguje ako páka, ktorá pretvára energiu z hydrolýzy ATP na mechanickú energiu; tiež viaže molekuly ľahkého reťazca,
- chvost (C-terminus) obsahuje viaceré väzobné miesta a určuje špecificitu molekuly (rôzne typy myozínu sa odlišujú hlavne v tejto doméne)
Ľahké reťazce sú tvorené menšími proteínmi, ktoré viažu Ca2+ (napr. kalmodulín). Väzba s vápnikom je charakteristická pre všetky proteíny zo skupiny myozínov.
Biologicky aktívna molekula myozínu tvorí monomér (myozín I) alebo homodimér (myozín II a V) s navzájom prepletenými chvostami ťažkého reťazca a hlavami smerujúcimi od seba.
Kinezíny link
Kinezíny sú molekulárne motory, ktoré sa pohybujú po vláknach mikrotubulov. Ich štruktúra je veľmi podobná molekule myozínu II. Skladajú sa z dvoch ťažkých a dvoch ľahkých reťazcov, dvoch globulárnych hlavičiek a dvoch predĺžených vzájomne prepletených chvostov.
Väčšina kinezínov sa pohybuje ku (+) koncu mikrotubulov, iba niektoré k (-) koncu. Tvoria monoméry, homodiméry alebo heterodiméry. Chvost kinezínov je, podobne ako u myozínov, najvariabilnejšou časťou molekuly a mnohokrát obsahuje väzobné miesta pre proteíny nachádzajúce sa v membránach organel alebo ostatné mikrotubuly.
Kinezíny majú úlohu vo vnútrobunkovej preprave vezikúl a organel, zúčastňujú sa bunkového delenia a separácie chromozómov.
Dyneíny link
Dyneíny sú molekulárne motory podobné kinezínom v tom, že využívajú mikrotubulárny systém bunky. Väčšina dyneínov však prepravuje tovar v opačnom smere ako kinezíny (k (-) koncu). Tento pohyb sa označuje ako retrográdny transport.
Dyneíny sú veľké molekuly. Skladajú z dvoch alebo troch ťažkých reťazcov a spravidla väčšieho množstva ľahkých reťazcov.
Najbežnejšie dyneíny sú cytoplazmatické dyneíny, ktoré tvoria typické homodiméry s dvomi veľkými hlavičkovými doménami. Cytoplazmatické dyneíny sa nachádzajú vo všetkých typoch eukaryotických buniek a zúčastňujú sa napr. transportu endocytických vezikúl, ktoré vznikajú vchlípením cytoplazmatickej membrány, smerom k lyzozómom.
Druhú, veľkú skupinu dyneínov tvoria axonemálne dyneíny. Tvoria heterodiméry alebo heterotriméry s dvomi, resp. tromi hlavičkovými doménami. Chvostové oblasti obsahujú väzobné miesta pre ostatné mikrotubuly. Axonemálne dyneíny zohrávajú významnú úlohu v pohybe riasiniek a bičíkov.
Pohyb molekulárnych motorov link
Základom pohybu je hydrolýza ATP a konformačné zmeny v rámci molekuly molekulárneho motora. Aktivita myozínu je silno spojená s prítomnosťou aktínu (bez neho je ATPázová aktivita hlavičky asi 4-5x nižšia). Aktivita kinezínu zas súvisí s väzbou na mikrotubulus.
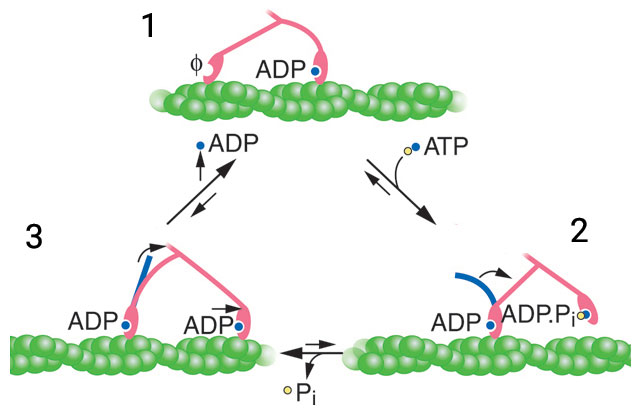
Princíp pohybu myozínu je nasledovný: Väzba myozínu s ATP spôsobí konformačnú zmenu v hlavičke, ktorá vedie k zníženiu afinity k aktínu (myozín sa od aktínu oddelí). Zároveň však prítomnosť ATP spôsobí veľkú konformačnú zmenu v strednej časti molekuly myozínu, čo spôsobí ohnutie ťažkého reťazca. Následná hydrolýza ATP spôsobí väzbu myozínu s aktínom na vzdialenejšom mieste aktínového vlákna. Uvoľnenie anorganického fosfátu z myozínu spôsobí jeho spätné ohnutie v oblasti krčku. Teraz je však myozín viazaný na aktínové vlákno, takže ohyb spôsobí zároveň posunutie smerom dopredu. Cyklus sa opakuje väzbou ďalšej molekuly ATP na myozín.
Pohyb kinezínu po vlákne mikrotubulu tiež súvisí s väzbou a hydrolýzou ATP. V tomto prípade väzba ATP s prednou hlavou spôsobí väzbu kinezínu s mikrotubulom, čoho následkom je posunutie zadnej hlavy smerom k (+) koncu a jej väzba s mikrotubulom. To je vlastne prvý "krok" molekuly smerom dopredu. Hydrolýza ATP spôsobí vyviazanie prednej hlavy z vlákna mikrotubulu. Čaká sa na väzbu ATP na zadnú hlavu, čoho následkom je druhý "krok" a uzavretie cyklu. Striedavá väzba ATP na prednú a zadnú hlavu je koordinovaná.
Rýchlosť pohybu myozínu sa výrazne odlišuje od jeho typu. Pre myozín II, ktorý sa vyskytuje v kostrových svaloch, je rýchlosť pohybu asi 4,5 µm/s. Rýchly pohyb je spojený s kontrakciou svalov. Pomalšie typy myozínu sú vhodnejšie pre transport vezikúl a organel v cytoplazme.
Rotujúce molekulárne motory link
Existujú molekulárne motory, ktorých molekuly vykonávajú cyklický krúživý pohyb. Príkladom je mitochondriálny membránový enzým ATP-syntáza alebo pohyb bakteriálnych bičíkov. Pohonom pre tieto molekulárne motory nie je hydrolýza ATP, ale rozdielna koncentrácia protónov (vodíkových katiónov, H+), príp. iných jednoduchých molekúl na vonkajšej a vnútornej strane membrány.
ATP-syntáza link
ATP-syntáza patrí medzi najvýznamnejšie molekulárne motory a enzýmy vôbec. Je súčasťou každej eukaryotickej bunky, pretože sa nachádza na vnútornej strane mitochondriálnej membrány (mitochondriálna ATP-syntáza), v membráne tylakoidov (chloroplastová ATP-syntáza) a stene gram-negatívnych baktérií (bakteriálna ATP-syntáza). Za popis štruktúry tohto enzýmu bola v roku 1997 udelená Nobelova cena za chémiu.
Úloha ATP-syntázy je naprosto esenciálna: syntéza molekuly adenozíntrifosfátu (ATP) z prekurzora adenozíndifosfátu (ADP) a anorganického fosfátu (Pi):
ADP + Pi → ATP
ATP-syntáza pre syntézu ATP využíva protónový gradient (H+).
Štruktúra ATP-syntázy link
ATP-syntáza je komplexný membránový proteín, ktorý sa skladá z dvoch hlavných podjednotiek:
- F1-podjednotka - prebieha tu syntéza ATP
- F0-podjednotka - tvorí protónovú pumpu, t.j. pór pre pohyb protónov cez membránu
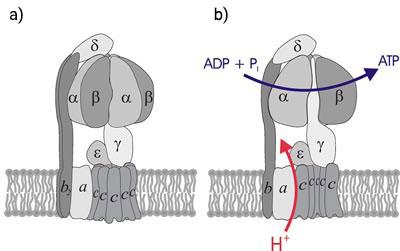
Štruktúra komplexného enzýmu je veľmi zaujímavá a nápadne pripomína prepracovanú mechanickú súčiastku vyrobenú ľudskou rukou. F1-podjednotku tvoria 3 alfa a 3 beta podjednotky, ktoré sa striedavo opakujú, pričom sú usporiadané do kruhu (ako mesiačiky v pomaranči) okolo stredovej gama-podjednotky asymetrického tvaru. F0-podjednotka tiež tvorí kruhovitú molekulu na spodnej strane F1-podjednotky, ktorá je spojená s gama-podjednotkou. F0-podjednotka s gama-podjednotkou tvoria rotor. Zvyšok F1-podjednotky tvorí stator.
Na obrázku je zjednodušená schéma ATP-syntázy. Odobraním horčíka z prostredia dôjde k disociácii F1-podjednotky, ktorú možno izolovať z vodnej fázy. F0-podjednotka ostáva súčasťou membrány. Navrátením horčíka do pôvodnej fyziologickej koncentrácie sa podjednotky znovu spoja za vzniku funkčného enzýmu ATP-syntázy.
Funkcia ATP-syntázy link
Rotor sa uvedie do pohybu prenosom protónov do vnútorného prostredia cez F0-podjednotku. Tá zároveň uvedie do pohybu asymetrickú gama-podjednotku F1-podjednotky. Vďaka jej asymetrickému tvaru spôsobí sériu konformačných zmien v alfa- a beta-podjednotkách, ktoré vedú k syntéze ATP z ADP a Pi.
Zdrojom protónov pre pohon ATP-syntázy je dýchací reťazec u mitochondrií alebo primárna fáza fotosyntézy u chloroplastov.
Pohyb baktérií link
Pohyblivé baktérie využívajú energiu rotujúcich molekulárnych motorov nachádzajúcich sa na báze bičíkov. Bakteriálny bičík, resp. jeho báza obsahuje 2 zložky:
- rotor je pohyblivou časťou bázy bičíka,
- stator obsahuje protónovú pumpu, ktorá prepúšťa protóny cez plazmatickú membránu, čím vytvára energiu pre rotor.
Molekulárne motory asociované s nukleovými kyselinami link
Medzi molekulárne motory môžeme zaradiť aj proteíny zúčastňujúce sa syntézy DNA alebo RNA (DNA-polymeráza, RNA-polymeráza, helikázy, ribozómy), ktoré sa pohybujú po vlákne nukleovej kyseliny v jednom určenom smere.
DNA-polymeráza a RNA-polymeráza zabezpečujú replikáciu, resp. transkripciu, a na svoj pohyb využívajú hydrolýzu nukleozidtrifosfátov (adenozíntrifosfát - ATP, guanozíntrifosfát - GTP, cytidíntrifosfát - CTP, uridíntrifosfát - UTP) alebo deoxynukleozidtrifosfátov (deoxyadenozíntrifosfát - dATP, deoxyguanozíntrifosfát - dGTP, deoxycytidíntrifosfát - dCTP, deoxytymidíntrifosfát - dTTP). Obidva enzýmy pridávajú nukleotidy v smere 5'-3'. Žiadna polymeráza nedokáže syntetizovať nukleovú kyselinu v opačnom smere, pretože to vylučuje chemizmus polymerizácie nukleotidov.
Helikáza je enzým, ktorého úlohou je rozvinúť (predpripraviť) dvojzávitnicu DNA pred jej replikáciou alebo transkripciou. Bez tohto nevyhnutného enzýmu by DNA-polymeráza nedokázala postupovať po replikačnej vidlici. RNA-polymeráza je komplexný enzým, ktorého súčasťou je aj zložka (tzv. transkripčný faktor) s helikázovou aktivitou. Helikáza využíva pre svoju aktivitu hydrolýzu ATP. Helikázy majú svoj význam aj pri oprave poškodení DNA.