Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Sekvenovanie novej generácie. [cit. 2024-04-25]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/sekvenovanie-novej-generacie>.
I. generácia sekvenovania link
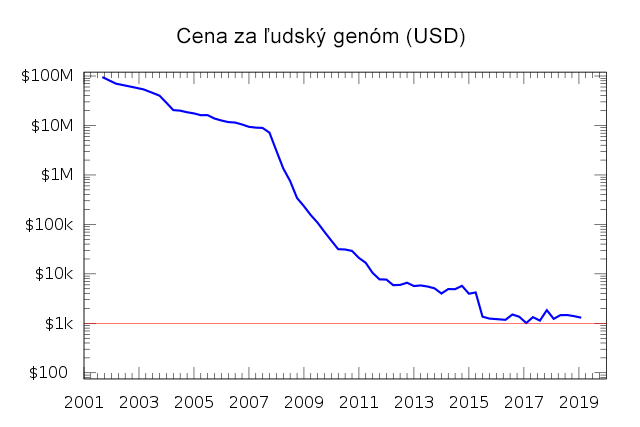
Odkedy FREDERICK SANGER (1918-2013) objavil v roku 1977 enzymatickú metódu sekvenovania DNA, založenú na použití modifikovaných dideoxy-nukleotidov, stala sa štandardom molekulárno-biologického výskumu na nasledujúcich 30 rokov. Do veľkej miery zmenila smerovanie mnohých biologických disciplín, genetiky a medicíny. Počas tohto obdobia dochádzalo k mnohým technickým vylepšeniam Sangerovej metódy, spresňovaniu výsledkov, zvyšovaniu bezpečnosti (zámena rádioaktívne značených nukleotidov za fluorescenčné farbivá), citlivosti a kapacity "čítanej" sekvencie. Do veľkej miery tomuto rozvoju napomohol Projekt sekvenovania ľudského genómu (HGP, Human Genome Project) (1990-2003), ktorý trval 13 rokov a stál takmer 1 bilión dolárov. Výsledkom projektu je osekvenovanie 99% ľudského genómu o veľkosti 3,3 miliardy bázových párov.
Významným krokom rozvoja sekvenovania bolo aj zavedenie prvku automatizácie s minimálnymi požiadavkami na personálnu obsluhu. V roku 1996 dala na trh firma Applied Biosystems prvý komerčný automatický sekvenátor. Avšak už ďalší rozvoj automatických sekvenátorov (napr. ABI 310 až 3730xl, od firmy Applied Biosystems) nedokázal viac dosiahnuť stanovený cieľ: sekvenovať celý ľudský genóm pod hranicu 1000 dolárov. V jednom behu bolo možné sekvenovať maximálne 384 (čo je rovné veľkosti reakčnej platničky) rôznych sekvencií s dĺžkou do 1000 bázových párov, každú najviac jedenkrát.
Obdobie monopolu klasického Sangerovho sekvenovania sa nazýva aj I. generáciou sekvenovania a trvá približne do roku 2005. Odvtedy sa sekvenovanie celých ľudských genómov časovo približuje niekoľkým dňom s cenou sekvenovania dosahujúcou 5 800 dolárov (r. 2012). Úmerne k tomu rastie aj množstvo novo-osekvenovaných genómov na takmer 10 000 ročne (r. 2012), pričom od roku 1995 do 2000 sa ich mohlo osekvenovať ani nie 50, prevažne vírusových alebo bakteriálnych.
II. generácia sekvenovania link
Za ďalší prielom v sekvenovaní DNA sa považuje obdobie 2005-2007, kedy hneď niekoľko firiem prináša na trh nové technológie, ktoré umožňujú sekvenovať veľké úseky DNA za oveľa menej peňazí a podstatne kratší čas:
- GS (Genome Sequencer) FLX System, od firmy Roche (r. 2005, pôvodne 454 pyrosequencer, vyvinutý firmou 454 Life Sciences)
- Illumina Genome Analyzer, od firmy Applied Biosystems (r. 2006, pôvodne Solexa 1G, vyvinutý firmou Solexa)
- SOLiD (Supported Oligonucleotide Ligation and Detection) DNA Sequencer (r. 2007), od firmy Applied Biosystems
- Ion Torrent (r. 2010), od firmy Life Technologies
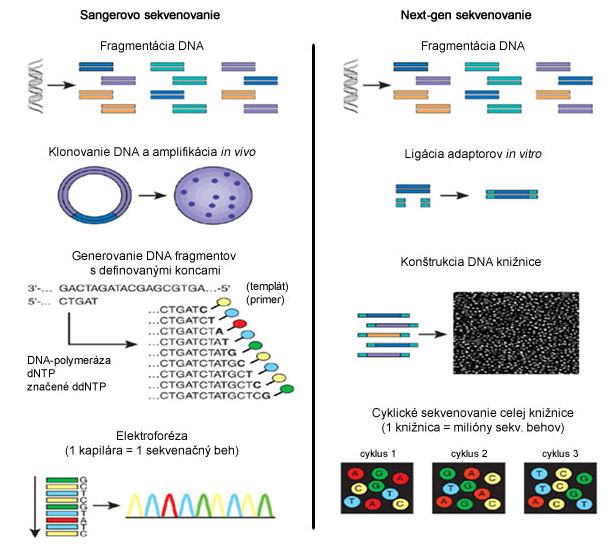
Spoločnou charakteristikou tejto tzv. II. generácie sekvenovania (angl. Next-Generation Sequencing) je použitie mikro- a nanotechnológií, ktoré umožnili minimalizáciu množstva vzorky a všetkých komponentov reakcie (chemikálie), a zároveň paralelné sekvenovanie veľkého množstva DNA sekvencií v jednom momente. Sú to vlastne modifikácie Sangerovho sekvenovania alebo sekvenovania syntézou. Na rozdiel od Sangerovho sekvenovania produkujú väčšinou kratšie reťazce (Sanger do 1000 bp vs. Illumina do 150 bp, Solid 2×35 bp, Ion Torrent 200-400 bp).
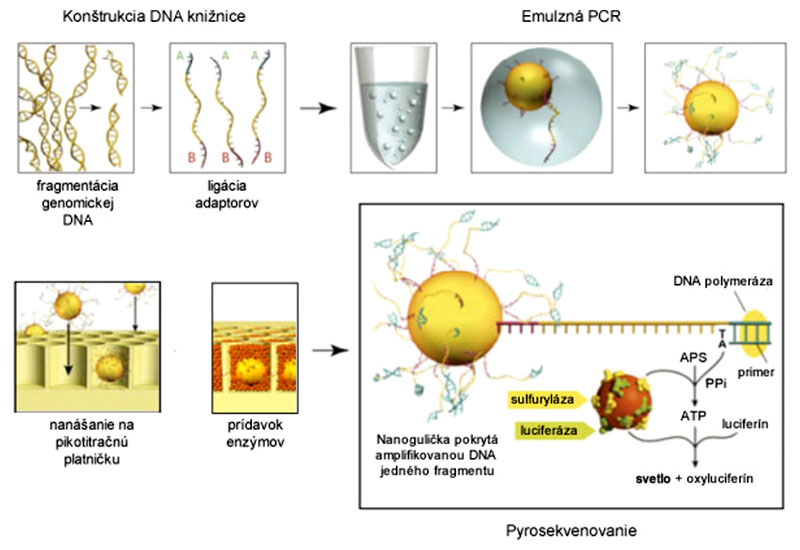
Zatiaľ čo klasické Sangerovo sekvenovanie prebieha na templáte, ktorým je PCR produkt alebo purifikovaná plazmidová DNA, príprava "templátu" pre tento nový typ sekvenovania je samostatným krokom, ktorý je ešte dôležitejší ako samotné sekvenovanie. Keďže princípom tejto metódy je masívne paralelné sekvenovanie viacerých vzoriek, templát je tvorený mnohými rôznymi sekvenciami, resp. fragmentmi DNA. Takýto súbor sekvencií sa zjednodušene nazýva DNA knižnica.(1)(2)(3)(4)
Celkovo tak sekvenovanie II. generácie pozostáva z 3 krokov:
- príprava DNA templátu, resp. DNA knižnice
- amplifikácia DNA knižnice
- samotné sekvenovanie
Tvorba DNA knižnice link
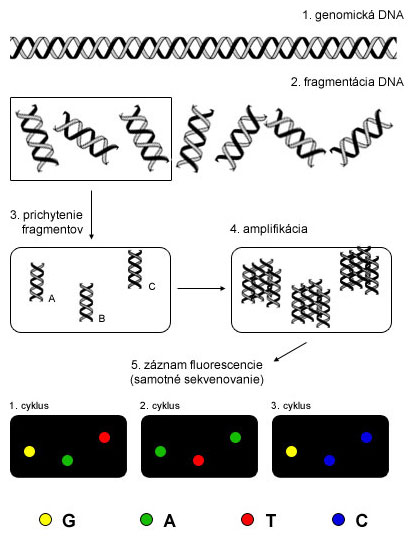
Genomická alebo akákoľvek DNA sa pred sekvenovaním musí posekať - fragmentovať na menšie kúsky (do 500-1000 bp), ktoré sa sekvenujú samostatne. Tieto fragmenty sa potom prichytávajú buď na pevnú podložku (Illumina) alebo na magnetické nanoguličky (454, Ion Torrent, SOLiD). Knižnica môže mať lineárny (Illumina) alebo kruhový tvar (454, Ion Torrent, SOLiD).
Amplifikácia DNA knižnice link
Amplifikácia DNA knižnice sa deje ešte pred samotným sekvenovaním z dôvodu zvýšenia detekčného signálu, ktorý vie poskytnúť len pomnožená DNA v mnohých kópiách. Amplifikácia prebieha priamo na mieste, v emulzii (emPCR - 454, Ion Torrent, SOLiD) alebo roztoku (Illumina). Ak je na hybridizáciu DNA fragmentov použité pevné sklíčko, pripravená knižnica je rozdelená na veľké množstvo zhlukov (angl. clusters) (Illumina), ktoré sa sekvenujú ako samostatné jednotky. Podobne, jedna nanogulička (454, Ion Torrent, SOLiD) predstavuje samostatnú sekvenačnú jednotku.
Sekvenovanie link
Sekvenovanie je založené na princípe syntézy komplementárneho vlákna z každého DNA fragmentu (454, Illumina, Ion Torrent) alebo ligácie 8-bázových sond (prób) (SOLiD). Ide o paralelné sekvenovanie celej knižnice. Každý zo štyroch voľných deoxy-nukleotidov (dNTP) je spravidla značený inou fluorescenčnou farbičkou (Illumina - značené dNTP, SOLiD - značené próby), alebo sekvenovanie prebieha cyklickým pridávaním a odmývaním jednotlivých nukleotidov (454, Ion Torrent). Po zaradení (inkorporovaní) nukleotidu alebo próby, dôjde k zaznamenaniu signálu (fluorescencie - Illumina, SOLiD; svetla - 454; zmeny pH - Ion Torrent) z každého klastra, resp. nanoguličky. Toto sa cyklicky opakuje, až kým nie je osekvenovaná celá knižnica.
Ak si jednotlivé klastery na sekvenačnej platničke označíme A-C, potom po troch cykloch sekvenovania sú sekvencie týchto DNA fragmentov nasledovné:
fragment A: ...GAG...
fragment B: ...ATC...
fragment C: ...TAC...
Analýza sekvenačných dát link
Amplifikácia DNA knižnice a samotné sekvenovanie prebieha automaticky, bez zásahu užívateľa. Odhliadnuc od rôznej technickej a časovej náročnosti prípravy DNA knižnice, je samotné vyhodnotenie sekvenovania vždy náročné. Najmä v prípade, ak sekvenujeme neznámu DNA (tzv. de novo sekvenovanie), ku ktorej zatiaľ neexistuje nijaká známa, príbuzná sekvencia - tzv. referenčná sekvencia, je skladanie výsledného genómu o veľkosti mnoho megabáz z fragmentov do 200 bázových párov niekedy veľmi prácne a vyžaduje nemalé vedomosti z oblasti bioinformatiky. Spracovanie gigabajtov dát je v neposlednom rade náročné aj na technické vybavenie (výkon počítača) a čas.
Pyrosekvenovanie link
Pyrosekvenovanie je technológia II. generácie sekvenovania, pôvodne vyvinutá firmou 454 Life Sciences v roku 2005 a inkorporovaná do komerčne dostupných pyrosekvenátorov rady 454 (dnes GS (Genome Sequencer) FLX System, firma Roche).
Príprava DNA knižnice (pyrosekvenovanie) link
Vzorka DNA sa pred samotnou prípravou DNA knižnice fragmentuje na úseky dlhé približne 300-500 bázových párov. Vstupné množstvo je asi 500 ng DNA.
K fragmentom DNA sa z obidvoch strán ligujú adaptory, krátke oligonukleotidy, odlišnej sekvencie (adaptor A a B). Nanoguličky sú pokryté kovalentne naviazanými oligonukleotidmi komplementárnymi k adaptorovej sekvencii A fragmentov DNA. Pomocou adaptoru A sa DNA z jednej strany prichytáva o pevnú podložku, resp. magnetické nanoguličky. (Adaptor B z druhej strany molekuly je zas komplementárny k primeru, ktorým sa iniciuje syntéza DNA počas sekvenovania.) Každá gulička tak predstavuje samostatný "reaktor", na ktorom prebieha sekvenovanie jedného konkrétneho fragmentu DNA. Ak by na jednej guličke bolo naviazaných viac fragmentov, došlo by k vzniku zmiešaného signálu a znehodnoteniu sekvenovania na danej guličke. Guličky sa tak miešajú s DNA vo veľkom nadbytku, aby boli štatisticky obsadené len jedným fragmentom DNA.
Po prichytení fragmentov na nanoguličku sa pripravuje PCR reakčný mix (mastermix), pričom PCR prebieha v emulznom oleji pre zabezpečenie optimálneho mikroprostredia pre amplifikáciu DNA. Olej, pokrývajúci povrch guličiek, zabráni úniku amplifikovaných fragmentov k susedným guličkám. Takáto PCR sa nazýva emulzná PCR (emPCR).
Napokon guličky premyjeme (odstráni sa olej) a izolujeme len tie, na ktorých sa nachádzajú fragmenty DNA. "Prázdne" guličky by značne znížili efektivitu sekvenovania, pretože by nebolo čo sekvenovať. Takto je knižnica, zložená z guličiek s naviazaným amplifikovaným fragmentom DNA, pripravená na samotné sekvenovanie.
Sekvenovanie (pyrosekvenovanie) link
Sekvenovanie na prístrojoch rady 454 prebieha v tzv. pikotitračných platničkách (cca 1x3 cm veľké), kde veľkosť jednotlivých jamiek je prispôsobená práve veľkosti jednej nanoguličky. Takáto platnička sa vkladá do prístroja, kde prebieha samotné sekvenovanie metódou pyrosekvenovania.(5)(6)(7)
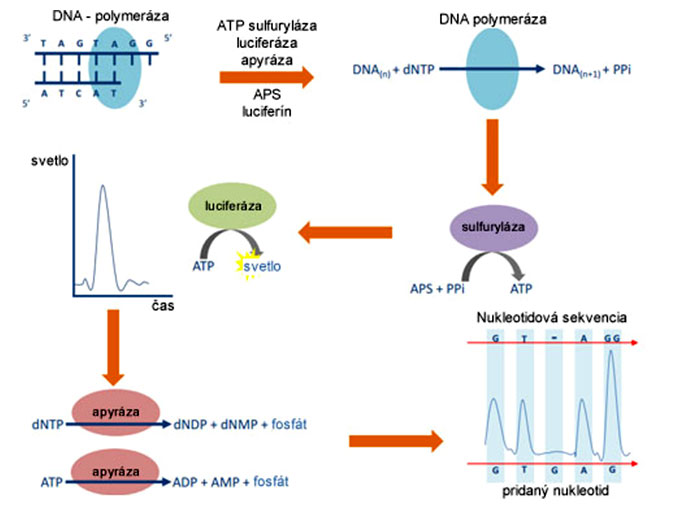
Chemizmus pyrosekvenácie je cyklický a pomerne zložitý. Nevyžaduje prítomnosť fluorescenčne značených nukleotidov, rozpoznávanie A,C,T,G je dané postupným pridávaním len konkrétnych, jednotlivých nukleotidov (dCTP, dGTP, dTTP, dATP) do každého cyklu polymerizácie.
Prítomných je niekoľko enzýmov a ďalšie špeciálne komponenty:
- DNA-polymeráza (enzým)
- ATP sulfuryláza (enzým)
- luciferáza (enzým)
- apyráza (enzým)
- adenozín-5-fosfosulfát (APS)
- luciferín
Po zaradení komplementárneho nukleotidu DNA-polymerázou, dochádza k vzniku pyrofosfátu (DNA(n) + dNTP → DNA(n+1) + PPi), ktorý enzým ATP sulfuryláza spotrebuje na tvorbu ATP z APS (APS + PPi → ATP). ATP funguje ako "palivo" pre luciferázu, ktorá premieňa luciferín na oxyluciferín, ktorý svieti, a prístroj zaznamená signál z každej jednej jamky predstavujúcej jednu nanoguličku, a teda jeden fragment DNA.
Napokon apyráza degraduje ATP (ATP → ADP + AMP + fosfát), ako aj nespotrebované nukleotidy (dNTP → dNDP + dNMP + fosfát), čím signál zanikne a "reštartuje" celý cyklus s novým nukleotidom.
Výhodou 454 technológie je dĺžka čítania (až do 1000 bp), presnosť (99,9%) a rýchlosť sekvenácie (6 hodín v prípade GS Junior System). Nevýhodou je pracnosť prípravy DNA knižnice a vysoká cena ($10 / 1 megabázu).
Illumina link
Illumina je technológia firmy Applied Biosystems, ktorá je reprezentovaná prístrojmi HiSeq, HiScanHQ, Genome Analyzer a MiSeq.(8)
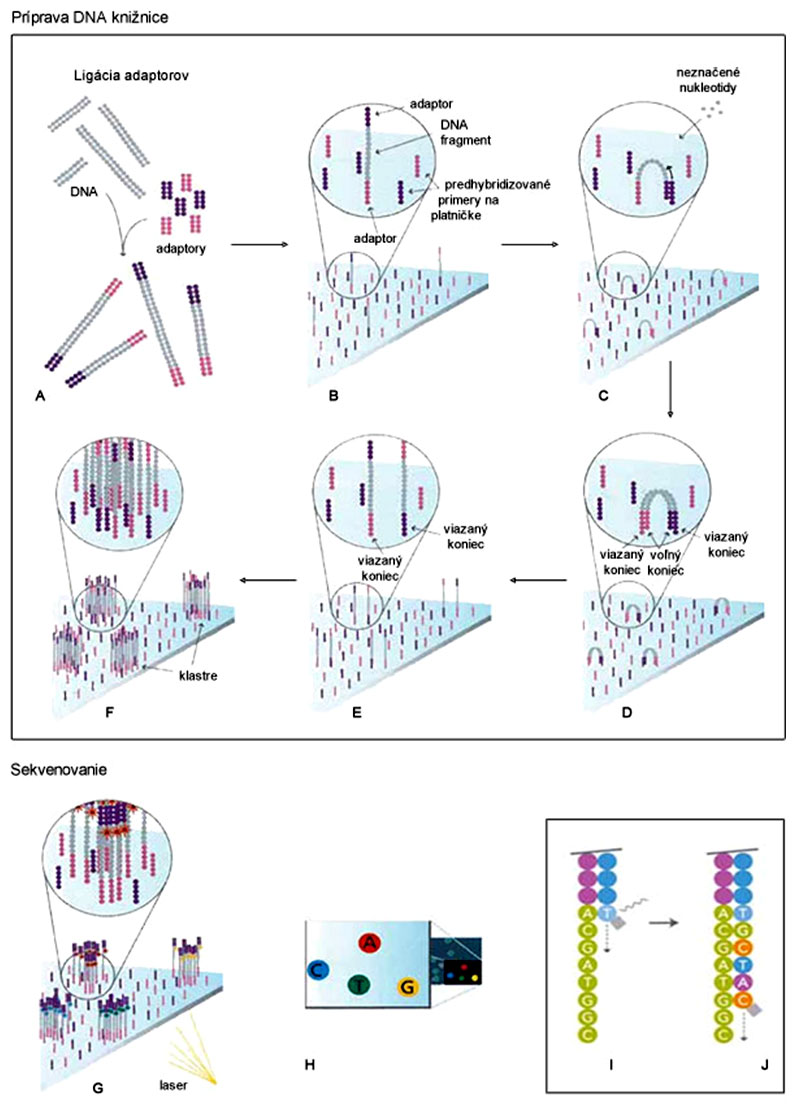
Príprava DNA knižnice pri systéme Illumina je principiálne podobná systému 454, ale odlišný je nosič jednovláknových DNA fragmentov, ktorým je sklenená platnička s predhybridizovanými primermi (obr., B). Tieto primery sú komplementárne k adaptorovej sekvencii DNA fragmentov (obr., A). Hybridizácia DNA fragmentov je priestorovo náhodná, ale dôležitá je ich primeraná hustota.
Po naviazaní DNA fragmentu na platničku (obr., B) dochádza k jeho ohybu a hybridizácii jeho voľného konca s adaptorom k predhybridizovanému primeru na platničke, takže pripomína most (angl. bridge) (obr., C). Následne prebehne amplifikácia (angl. bridge-PCR) na platničke s využitím tohto primeru, čím vznikne "dvojvláknový most" (obr., D). Po následnej denaturácii sa štruktúra rozpadne (vlákna sa "vystrú"), ale už sú prítomné 2 jednovláknové molekuly, uchytené na platničke (obr., E). Takto postupne vznikne niekoľko 1000 kópií daného DNA fragmentu v tesnej blízkosti, čím sa vytvorí klaster (obr., F), funkčne ekvivalentný jednej nanoguličke systému 454.
Samotné sekvenovanie sa však od 454 odlišuje, ide o sekvenovanie syntézou spojené s reverzibilnou termináciou polymerizácie (obr., I,J). Mastermix obsahuje primery, DNA-polymerázu a 4 rôzne fluorescenčne značené nukleotidy s reverzibilne odštiepiteľným terminátorom na 3'-konci, ktoré prechodne zastavujú polymerizáciu (fungujú podobne ako dideoxy-nukleotidy pri Sangerovom sekvenovaní). Po naviazaní týchto nukleotidov sa platnička premyje (odstránia sa nenaviazané nukleotidy) a laser zaznamená fluorescenciu podľa typu nukleotidu (obr., G,H,I), resp. fluorescenčnej farbičky (A,C,T,G). Napokon sa terminátor z 3'-konca odštiepi (obr., I,J) a do reakcie znovu vstupujú jednotlivé komponenty, ktoré zahája ďalšiu polymerizáciu a ďalšie meranie fluorescencie.
Najväčšou výhodou Illuminy je cena sekvenácie, ktorá sa pohybuje na úrovni $0,07 / 1 megabázu. Nevýhodou je krátke čítanie (DNA fragmenty do 150 báz) a nižšia presnosť, predovšetkým na konci behu.
Ion Torrent link
Ion Torrent je technológia firmy Life Technologies a divízie Applied Biosystems, komercionalizovaná v roku 2010. Hlavnou funkčnou jednotkou prístrojov (Ion PGM, Ion Proton) je čip, ktorý rozhoduje o výkone a kapacite sekvenovania. Čip je zároveň detektorom, ktorý prenáša chemickú informáciu, zakódovanú v A,C,T,G, na digitálnu informáciu (1,0) v závislosti od prítomnosti, resp. neprítomnosti konkrétneho nukleotidu v danom cykle.(9)
DNA knižnica je fixovaná na nanoguličku a vzniká amplifikáciou DNA fragmentov pomocou emPCR. Signál zaznamenáva prístroj prostredníctvom jemnej zmeny pH, spôsobenej vylúčením protónu (H+) po úspešnej inkorporácii nukleotidu pri syntéze vlákna. Ide teda, podobne ako v predchádzajúcich technológiách, o sekvenovanie syntézou. Podobne, ako v prípade 454, zaradenie dvoch za sebou idúcich rovnakých nukleotidov v jednom cykle vedie k dvojnásobnému vylúčeniu H+ a zaznamenaný je výraznejší peak. Rozlíšenie nukleotidov (A,C,T,G) je, podobne ako pri 454, dané cyklickým pridávaním jednotlivých voľných dNTP do reakcie.
Výhodou Ion Torrentu je jednoznačne rýchlosť a jednoduchosť: priama, chemická detekcia, bez potreby skenovania, kamier alebo svetla. Nevýhodou je relatívne vyššia cena ($1 / 1 megabázu).
SOLiD link
SOLiD (Sequencing by Oligonucleotide Ligation and Detection) je takisto technológia firmy Applied Biosystems, ktorá, na rozdiel od predchádzajúcich technológií, nevyužíva sekvenáciu syntézou ale ligáciou sond (prób) hybridizovaných k DNA knižnici. DNA knižnica je amplifikovaná emulznou PCR na nanoguličkách, ktoré sú nanesené na sklenenú podložku.(10)
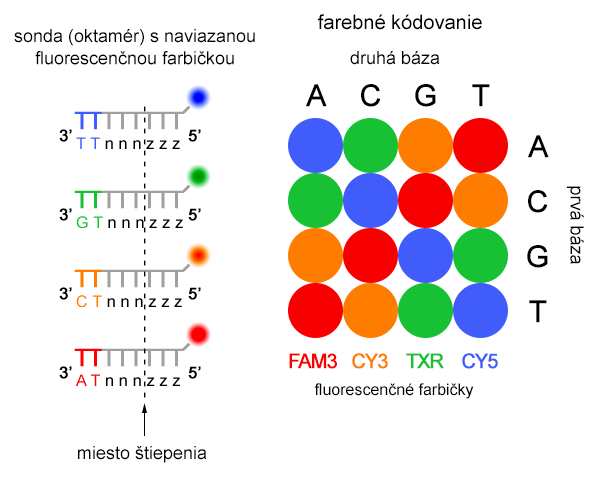
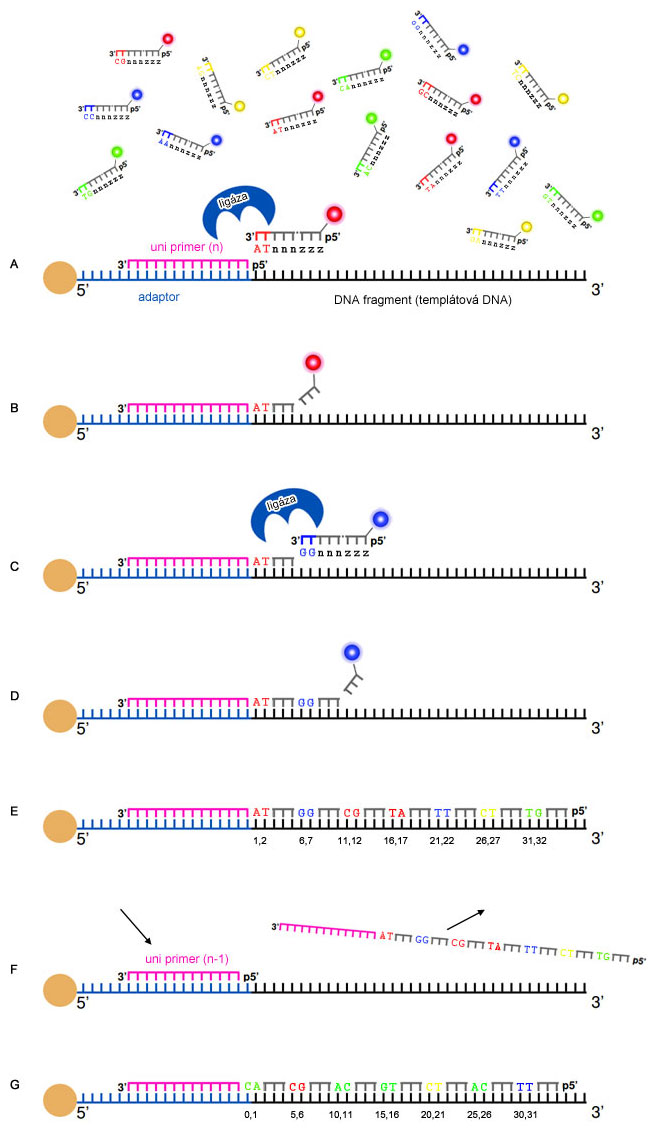
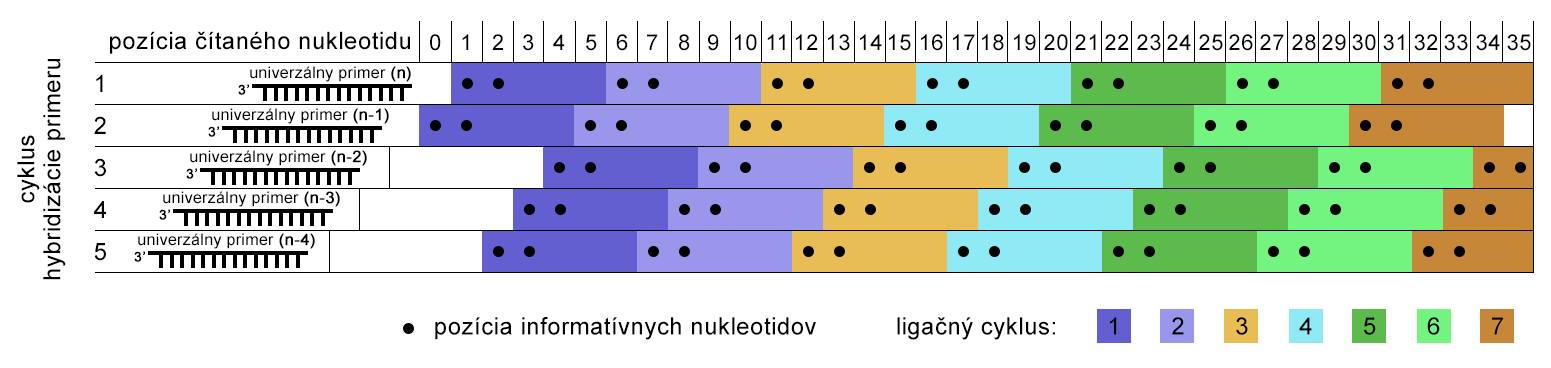
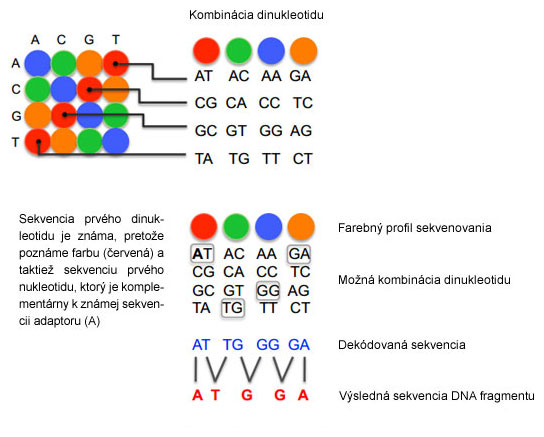
Najprv hybridizuje univerzálny primer k adaptorovej sekvencii a následne k nemu liguje (pomocou ligázy) sekvenčne špecifická sonda s naviazanou fluorescenčnou farbičkou na 5'-konci. Sonda je oktamér (8 nukleotidov), ktorá obsahuje 2 informatívne nukleotidy na 4.-5. (alebo 1.-2. u novších verzií, na obrázku nižšie) pozícii, zvyšných 6 nukleotidov sú univerzálne (z) alebo degenerované bázy (n), párujúce sa s každým nukleotidom. Štyri fluorescenčné farbičky (FAM, CY3, TXR, CY5) určujú pomocou premysleného farebného kódu (na obrázku) všetkých 16 možných dinukleotidov, pričom k jednej farbičke prislúchajú 4 dinukleotidové kombinácie.
Po ligácii sondy dochádza k čítaniu fluorescencie pomocou laseru (obr., A) a následnému odštiepeniu 3 univerzálnych báz (vrátane fluorescenčnej farbičky) z 5'-konca sondy (obr., B). Cyklus pokračuje ligáciou ďalšej sondy na základe komplementarity informatívneho dinukleotidu, a opäť sa zaznamená fluorescencia (obr., C,D). Cyklus ligácií sa opakuje 5 až 7-krát, takže sa prečíta 25 ((8-3)×5) alebo 35 báz ((8-3)×7) (obr., E).
Výsledkom jedného cyklu ligácií je prečítanie dinukleotidov, medzi ktorými sú 3 bázy neznáme (obr., E). Ako však zistíme, ktorý nukleotid je na akej pozícii, keď rovnakú farbičku majú až 4 kombinácie dinukleotidov? Tak, že v ďalšom kroku nastane "reštart" (denaturácia) a do reakcie vstupuje univerzálny primer, skrátený o 1 nukleotid z 3'-konca (obr., F). K nemu opäť ligujú sondy ako v prvom kroku, ale zároveň dochádza k prekryvu dinukleotidov z prvého cyklu (obr., G). V tomto kroku však máme ďalšiu dodatočnú informáciu, pretože vieme akou bázou začína dinukleotid prvej sondy, keďže je zo známej sekvencie kompatibilnej k adaptoru.
Aby bola prečítaná celá sekvencia, je potrebný reštart 4-krát, vždy s univerzálnym primerom skráteným o 1 nukleotid (prvý univerzálny primer je n, po reštartoch je dĺžka a sekvencia primerov n-1, n-2, n-3, n-4). Z obrázku dole vyplýva, že poradie hybridizačných krokov neurčuje zároveň aj poradie čítania nukleotidov v sekvencii, ale sekvencia DNA fragmentu začína pri čítaní univerzálnym primerom 2 a pokračuje primermi 1, 5, 4 a končí cyklom s primerom 3.
Dekódovanie sekvencie je určené práve farebným kódom a sekvenciou prvej bázy pri čítaní univerzálnym primerom 2 (t.j. n-1).
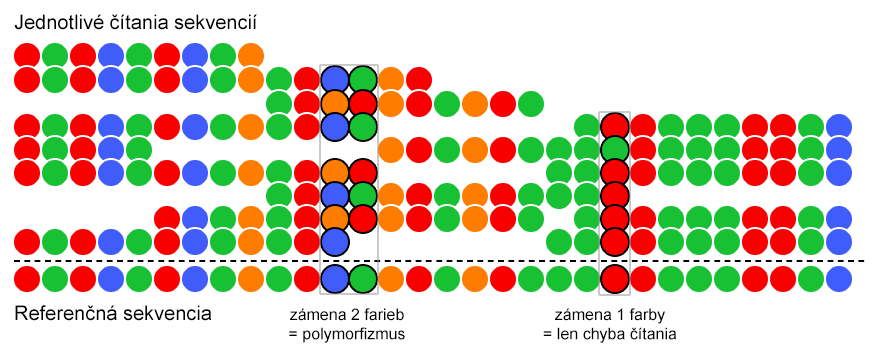
Z uvedeného taktiež vyplýva, že každý nukleotid je čítaný dvakrát, čo výrazne zvyšuje presnosť tejto metódy sekvenovania (až 99,94%). Dvojnásobné čítanie nukleotidov a využitie farebného kódu taktiež umožňuje identifikáciu bodovej mutácie (polymorfizmu), čo je výhoda oproti ostatným sekvenáciám II. generácie, ktoré majú s vyhodnotením polymorfizmu značné problémy.
Ďalšou výhodou je nízka cena ($0,13 / 1 megabázu). Nevýhodou je čítanie krátkej sekvencie, a to dokonca dvakrát (2×25 alebo 2×35 báz), a teda pomalý beh (až 8 dní, v závislosti od veľkosti DNA knižnice).
III. generácia sekvenovania link
Zástupcom III. generácie sekvenovania DNA je systém PacBio od firmy Pacific Biosciences, ktorý bol komercionalizovaný v roku 2011. Táto technológia nevyžaduje počiatočnú amplifikáciu DNA knižnice, čo znižuje výskyt spontánnych mutácií vzniknutých chybovosťou DNA-polymerázy. Technológia je ešte len v začiatkoch, o čom svedčí aj relatívne nízka presnosť výstupov: asi 77% v porovnaní s >98% presnosťou sekvenátorov II. generácie. Nepochybne však "sekvenovanie jednej molekuly v reálnom čase" (SMRT, Single Molecule Real Time Sequencing) je cieľom molekulárnej biológie v najbližších rokoch.
| 454 GS FLX | HiSeq 2000 | SOLiDv4 | Ion 318 Chip v2 | Sanger 3730xl | |
| sekvenácia | pyrosekvenovanie | sekvenovanie reverzibilnou termináciou syntézy | ligácia sond | sekvenovanie syntézou, zmena pH | dideoxy-nukleotidy, syntéza rôzne veľkých molekúl |
| dĺžka čítania | do 1000 bp | do 150 bp | 2×35 | 200 bp | 400-900 bp |
| presnosť | 99,9% | 98% | 99,94% | 99% | 99,999% |
| počet behov | 1 M | 3 G | 1200-1400 M | 4-5,5 M | 1 / kapilára |
| dátový výstup | 0,7 GB | 600 GB | 120 GB | 0,6-1 GB | 1,9-8,4 kB |
| čas behu | 24 hod | 3-10 dní | 7 dní | 2 hod | 20 min - 3 hod |
| cena za 1Mbp ($) | $10 | $0.07 | $0.13 | $1 | $2400 |
Aplikácie sekvenačných technológií novej generácie link
Okrem de novo sekvenovania celých genómov vyšších eukaryotov, vrátane polyploidných rastlín s obrovskou genetickou informáciou, nachádzajú technológie sekvenácie II. a III. generácie široké uplatnenie aj pri sekvenácií menších genómov. Pomerne rutinná je dnes už záležitosť sekvenovať nové bakteriálne či vírusové kmene, a analyzovať tak vplyv mutácií na zmenený fenotyp. Metagenomika je oblasť v rámci molekulárno-biologického výskumu, ktorá sa zaoberá identifikáciou nových mikroorganizmov z rôznych prostredí, vrátane črevnej mikroflóry. Na štúdium využíva práve nové metódy sekvenovania.
V budúcnosti by sa mohlo stať rutinným aj sekvenovanie ľudských genómov a identifikácia tzv. markerov, ktoré zapríčiňujú predispozície na genetické a multifaktoriálne ochorenia, akými sú napr. cukrovka, vysoký krvný tlak, Alzheimerova choroba a mnohé ďalšie, a včas im predchádzať. Každá choroba by dostala určitý profil (známe mutácie, identifikované po celom ľudskom genóme), ktorý by sa porovnával so sekvenovanou DNA pacientov či zdravých jedincov. Výstupom takéhoto vyšetrenia by bola tabuľka s percentom pravdepodobnosti výskytu daného ochorenia u človeka. Momentálne dostupné technológie by to v podstate mohli umožniť už aj dnes, ale cena je stále relatívne vysoká, aby sa to stalo rutinným vyšetrením. Treba byť opatrný a netreba zabúdať ani na etické problémy plynúce z dostupnosti kompletnej genetickej informácie pre lekárske a vedecké účely, ako aj na možnú spoločenskú či pracovnú diskrimináciu plynúcu z takejto genetickej analýzy.(13)
Nemusíme sa však obmedzovať len sa sekvenovanie genómov, t.j. DNA, ale po prepise mRNA do cDNA je možné sekvenovať celé transkriptómy a zistiť génový expresný profil bunkových línií alebo tkanív a celých orgánov. Toto je náhrada zdĺhavej a nie príliš informatívnej metódy northern blotu či microarray (čipov). Aktuálnym medicínskym problémom je predovšetkým zisťovanie expresného profilu nádorov, čo má priamy diagnostický, ako aj terapeutický význam. Rovnako štúdium epigenetiky (metylácia DNA ako významný regulačný faktor génovej expresie) metódami sekvenácie novej generácie je dnes možné a používané.
Momentálny boom v oblasti sekvenovania nukleových kyselín je o to fascinujúcejší, že rýchlosť, s akou vznikajú nové a lepšie technológie, môže skutočne zmeniť tvár biológie už v najbližších rokoch. Nevyhnutnou potrebou budú predovšetkým bioinformatici, pretože funkčná analýza genómov nekončí po zistení poradia písmenok A,C,T,G v reťazci. Ešte pred 10 rokmi (r. 2003) bolo nepredstaviteľné, že by sme vedeli sekvenovať tak obrovské úseky DNA s tak nízkymi finančnými a technickými nárokmi, dokonca v rutinných laboratórnych podmienkach. Štúdium a využitie týchto nových technológií má preto obrovský praktický význam.
- Hajnal M.: Metodika bioinformatickej analýzy dát zo sekvenovania novej generácie typu RNA-seq. (2013). Fakulta informatiky, Masarykova Univerzita. Bakalárska práca.
- Glaus P.: Sekvenovanie génov očami informatika. The University of Manchester.
- Next Generation Sequencing: An Overview - Axygen Biosciences
- Golstein C., Caboche M.: Next-generation high-throughput sequencing technologies. (2008). Technologies of the Future, INRA.
- 454 Sequencing Roche.
- Groom A.: Pyrosequencing. Insitute of Genetic Medicine, New Castle University.
- Rodney E. Shackelford, D.O., Ph.D.: Molecular Pathology: DNA sequencing: Pyrosequencing. (2011). Tulane University.
- Illumina Sequencing Technology (2010). Illumina.
- Ion PGM System Specifications
- Wang Y.: SOLiD Bioinformatics Overview. (2009). Applied Biosystems, Life Technologies.
- Liu et al.: Comparison of next-generation sequencing systems. (2012). J Biomed Biotechnol. Article ID 251364, doi:10.1155/2012/251364.
- Vídeňská P.: Next generation sequencing. MikroDok.
- National Human Genome Research Insitute. DNA Sequencing Costs.