Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Extrakcia proteínov. [cit. 2024-04-19]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/extrakcia-proteinov>.
Purifikácia nadexprimovaného proteínu tvorí druhú, a nemenej dôležitú, fázu produkcie čistého rekombinantného proteínu v heterologickom expresnom systéme. Málokedy získavame rekombinantný proteín priamo z tekutého, mimobunkového (extracelulárneho) prostredia (kultivačného média), hoci niektoré expresné systémy takúto sekréciu proteínov umožňujú. Prvým krokom k purifikácii akejkoľvek molekuly z biologického materiálu je rozrušenie bunkovej steny a cytoplazmatickej membrány, čím dôjde k jej uvoľneniu do roztoku.
Poznáme niekoľko spôsobov disrupcie buniek:
- opakované zamrazenie a rozmrazenie materiálu - disrupciu spôsobia tvoriace sa ľadové kryštáliky (môže denaturovať niektoré proteíny)
- mechanické - homogenizácia v trecej miske alebo zložitejších aparatúrach
- chemické - rôzne silné detergenty, rozpúšťadlá (môžu denaturovať niektoré proteíny; nutné použiť pri solubilizácii membránových proteínov - napr. Triton X-100, CHAPS)
- enzymatické - pôsobenie enzýmov na bunkové steny (napr. celulázy, pektinázy, lyzozým pre baktérie, zymoláza pre kvasinky)
V prípade proteínov závisí od ich lokalizácie (napr. bunkové jadro, cytoplazma, membránový proteín, periplazmatická lokalizácia v prípade gram-negatívnych baktérií) ako aj od pôvodu a charakteru buniek (prítomnosť bunkovej steny), akú "agresívnu" metódu (príp. kombináciu metód) musíme použiť, aby sme:
- uvoľnili dostatočné množstvo proteínu do roztoku, t.j. rozpustnej (solubilnej) fázy
- zachovali tvar (konformáciu) a biologickú aktivitu proteínu
Homogenizácia link
Homogenizácia patrí medzi mechanické spôsoby disrupcie buniek. Po homogenizácii sa dostanú proteíny do roztoku, ktorý musí mať určité primerané zloženie a pH, aby nedošlo k strate ich biologických vlastností. Hovoríme mu tlmivý roztok (pufor), pretože "tlmí" výkyvy pH, ktoré sú spôsobené rôznymi prítomnými chemickými zlúčeninami.
| pufor | rozsah pH |
| fosfátový (NaH2PO4 + Na2HPO4) | 5,8 - 8,0 |
| Tris-HCl | 7,0 - 9,0 |
| citrátový (octan sodný + kys. citrónová) | 3,0 - 6,2 |
Zdroj: EMBL, Protein PurificationExtraction and Clarification
Najpoužívanejšími homogenizátormi sú:
- Potterov homogenizátor - materiálom sú najčastejšie bunkové kultúry živočíšneho pôvodu, ktoré sa homogenizujú trením piestu o sklenený mažiar v tvare valca
- ultrazvukový homogenizátor, tzv. sonifikátor - na disrupciu buniek využíva ultrazvukové vlny
- French press - na bunkovú suspenziu je pomocou hydraulickej pumpy vyvinutý veľký tlak (6000-10000 psi), následne je suspenzia náhle vypustená úzkou kapilárou, pričom bunky praskajú vplyvom dekompresie a strižnej sily pri opúšťaní komory; French press sa používa predovšetkým na extrakciu proteínov z bakteriálnych buniek
- homogenizátory využívajúce na disrupciu buniek magnetickú silu pretransformovanú na kinetickú energiu guličiek, ktoré trením a miešaním suspenzie rozrúšajú bunkové povrchy; používajú sa často na extrakciu proteínov zo živočíšnych orgánov a tkanív
Výsledkom homogenizácie je suspenzia - homogenát.
Aditíva tlmivého roztoku link
Použitie rôznych chemických látok ako prímesí (aditív) tlmivého roztoku nie je vždy nevyhnutné. Sú to látky, ktoré pomáhajú solubilizovať alebo stabilizovať niektoré proteíny. Vhodne zvolené aditíva by nemali ovplyvňovať ďalšie purifikačné procedúry, príp. by mali byť odstrániteľné z roztoku dialýzou alebo gélovou filtráciou.
| skupina | príklad | výsledná koncentrácia | účel použitia |
| soli | NaCl, KCl, (NH4)2SO4 | 50-150 mM | udržanie iónovej sily roztoku, interakcia proteínov s nosičom, precipitácia proteínov |
| detergenty | Triton X-100, NP-40, CHAPS | 0,1-1% | solubilizácia membránových proteínov |
| glycerol | - | 5-10% | stabilizácia a prevencia agregácie proteínov |
| sacharidy | glukóza, sacharóza | 25 mM | stabilizácia membrán lyzozómov je prevenciou vylúčenia proteáz |
| chelátory ("vychytávače") dvojmocných katiónov | EDTA, EGTA | 1 mM | redukcia oxidačného poškodenia, inhibícia niektorých proteáz |
| redukčné činidlá | DTT | 1-10 mM | redukcia oxidačného poškodenia, vo vyššej koncentrácii redukcia S-S väzieb |
| β-merkaptoetanol | 0,05% | ||
| ligandy, ióny kovov | Mg2+, ATP, GTP | 1-10 mM | stabilizácia niektorých proteínov |
Ultracentrifugácia link
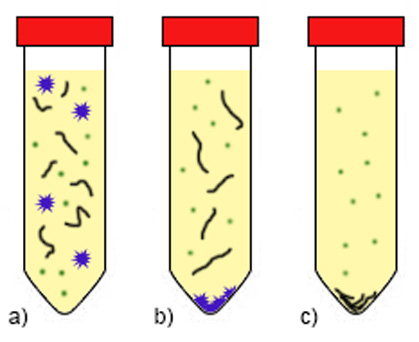
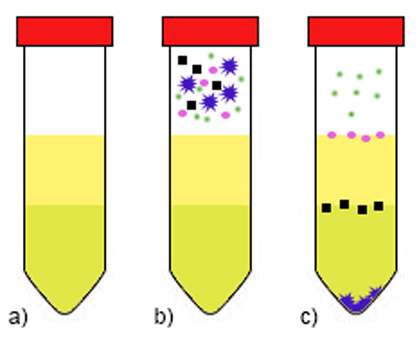
Homogenát obsahuje rôzne veľké a ťažké častice (bunkový debris, t.j. zvyšky buniek, organel, membrán) a rozpustný (solubilný) materiál. Použitím viacerých cyklov centrifugácie s odlišnými rýchlosťami a časom vieme do istej miery separovať určité frakcie so želanými proteínmi. Centrifugácia pri veľmi nízkych otáčkach (500 g / 10 min) umožňuje izolovať najťažšie bunkové jadrá), takže sa hodí na extrakciu jadrových proteínov. Ak predpokladáme, že náš rekombinantný proteín je solubilný, centrifugujeme pri vyšších otáčkach (10 000 g / 20 min), čím sa zbavíme väčšiny nepotrebného, kontaminujúceho materiálu. Naproti tomu, izolácia membránových častíc s membránovými proteínmi vyžaduje ultracentrifugáciu (100 000 g / 60 min) (obr., A3). Centrifugácia rozdeľuje suspenziu na nerozpustný sediment (pelet) (na dne skúmavky) a supernatant (roztok).
Niekedy sa však môže hodiť diferenciálna centrifugácia v hustotnom gradiente (napr. sacharózy), najmä ak chceme od bunkového debrisu oddeliť bunkové organely alebo ľahšie inklúzne telieska, tvorené agregátmi rekombinantného proteínu. V tom prípade sa najťažší debris usadí v spodnej časti skúmavky, ale ľahšie častice nevedia klesnúť pod hladinu koncentrovanejšieho roztoku sacharózy. Výsledkom je pelet, rozdelený na jednotlivé frakcie, podľa hustoty sacharózy. Solubilný materiál sa bude nachádzať vždy v najvrchnejšej frakcii, pretože je najľahší.
Precipitácia proteínov link
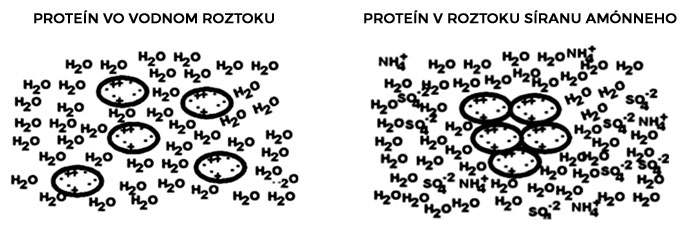
Proteíny je ďalej často potrebné selektívne vyzrážať - precipitovať z heterogénneho roztoku. Najpoužívanejšou chemikáliou je síran amónny - (NH4)2SO4, ktorý spôsobuje tzv. postupné vysoľovanie (salting-out efekt) proteínov v závislosti od ich rozpustnosti v roztoku s rôznou iónovou silou. Princípom je v podstate "súperenie" síranu amónneho s proteínom o molekuly rozpúšťadla (vody). Precipitovaný proteín tvorí agregáty (cez hydrofóbne interakcie), takže je oddeliteľný od solubilnej fázy centrifugáciou. Týmto spôsobom je možné, so zvyšujúcou sa koncentráciou síranu amónneho, pozbierať niekoľko frakcií, ktoré obsahujú rôzne proteíny, a analyzovať tieto frakcie na prítomnosť predmetného rekombinantného proteínu (napr. pomocou SDS-PAGE).
Precipitácia proteínov týmto spôsobom nespôsobuje denaturáciu proteínov. Síran amónny je z roztoku odstrániteľný dialýzou. Je to rýchla a lacná metóda na prvotné odstránenie väčšiny kontaminujúcich proteínov.
Dialýza link
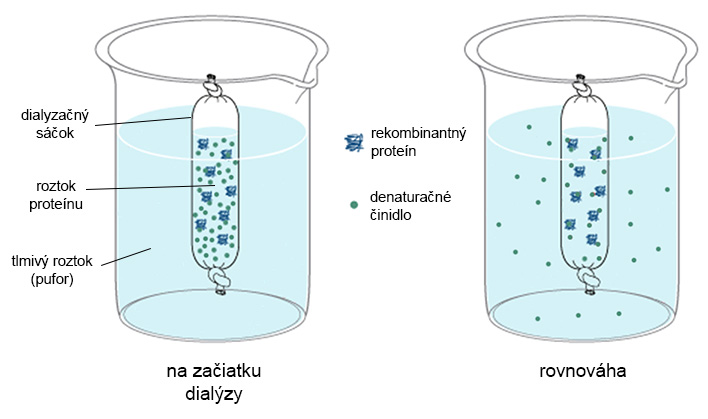
Dialýza roztoku proteínu je metóda na odstránenie nízkomolekulových chemických látok z roztoku, ktoré by mohli negatívne ovplyvňovať ďalšie purifikačné kroky, príp. biologické vlastnosti proteínu. Dialýza prebieha v dialyzačných sáčkoch za stáleho miešania v tlmivom roztoku a pri nízkej teplote (4°C). Póry dialyzačného sáčku prepúšťajú len malé molekuly, kým nenastane rovnováha medzi zložením obidvoch roztokov. Proteín ostáva uzavretý vo vnútri dialyzačného sáčku.
Prostredníctvom dialýzy možno niektoré proteíny renaturovať do biologicky aktívnej konformácie. Aby bola renaturácia čo najefektívnejsia, musí prebiehať veľmi pomaly, často vo veľmi zriedenom roztoku, a teda veľkom objeme.