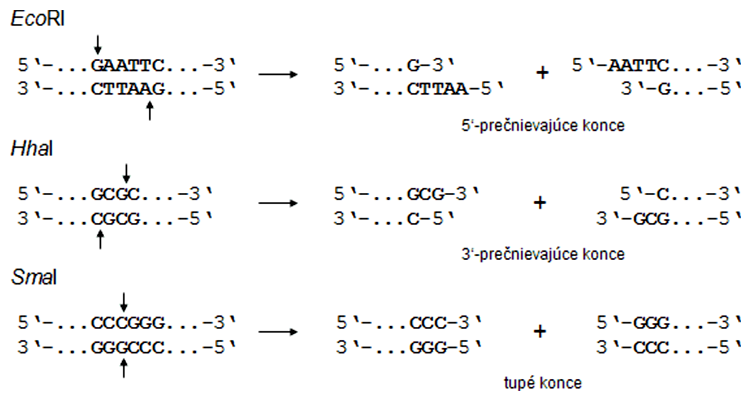Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Klonovanie DNA. [cit. 2024-04-20]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/klonovanie-dna>.
S nástupom rekombinantných DNA technológií v 70. rokoch 20. storočia nastáva enormný rozvoj molekulárnej biológie, takže 21. storočie môžeme právom nazvať "érou biológie". Pomocou rekombinantných DNA možno vnášať cudzie gény do živých organizmov, a tým modifikovať ich vlastnosti. Takéto cieľavedomé genetické manipulácie so živými organizmami, nazývané aj genetické inžinierstvo, sú dnes najkontroverznejšou oblasťou genetického výskumu. Využívanie organizmov s modifikovaným genómom je základom pre komerčnú masovú produkciu látok (hormóny, proteíny) v biologických systémoch, ktoré sú zaujímavé z pohľadu spotrebiteľa. Táto oblasť patrí pod záštitu molekulárnych biotechnológií alebo skrátene len biotechnológií.
Rekombinantné DNA technológie sú tiež základom génovej terapie, ktorá má do budúcnosti obrovský potenciál v riešení problémov genetických a onkologických ochorení, na ktoré klasickými metódami liek neexistuje, príp. sa ich dnešná liečba zameriava len na symptómy a nie ich podstatu, a neraz má vedľajšie nežiadúce účinky.
Tvorba rekombinantných DNA molekúl link
Rekombinantné DNA sú molekuly zložené z dvoch a viacerých sekvencií DNA, ktoré sa prirodzene nikdy nenachádzajú spoločne (pri sebe). Sú to teda v laboratóriu vytvorené umelé molekuly molekulárnymi technikami využitím rôznych enzýmov, predovšetkým restrikčných endonukleáz (restriktáz). Sú to enzýmy izolované z baktérií, u ktorých majú ochrannú funkciu pred prijatím cudzej DNA. Prvýkrát boli objavené v bakteriálnych kmeňoch rezistentných voči fágovej infekcii. Dvojvláknová DNA sa pôsobením restrikčných endonukleáz štiepi na kratšie fragmenty v presne definovaných miestach, pričom aj tieto fragmenty majú presne sekvenčne definované konce. To má veľký význam v molekulárnej biológii, pretože ak majú dve DNA sekvencie rovnaké konce, môžu byť spojené do jednej molekuly - rekombinantnej DNA.
Klonovací vektor link
Princípom molekulárneho klonovania je teda príprava rekombinantnej molekuly DNA, ktorá sa vnáša do nejaké hostiteľského organizmu (napr. baktérií alebo kvasiniek), pričom samotné klonovanie, tzn. zmnoženie počtu kópií danej rekombinantnej molekuly nastáva jej prirodzenou replikáciou v tomto organizme. Rekombinantná molekula je teda tvorená "naším" génom záujmu, ktorý sa pomocou restrikčných miest vkladá do nosičovej molekuly DNA, tzv. vektora. Vložený gén vo vektore sa nazýva inzert. Ak je funkciou vektora klonovanie, t.j. namnoženie počtu kópií nášho génu záujmu potrebné k ďalším analýzam, nazýva sa klonovací vektor. Najčastejšie je klonovacím vektorom rekombinantná molekula plazmidovej DNA, skrátene rekombinantný plazmid.
Restrikčné endonukleázy link
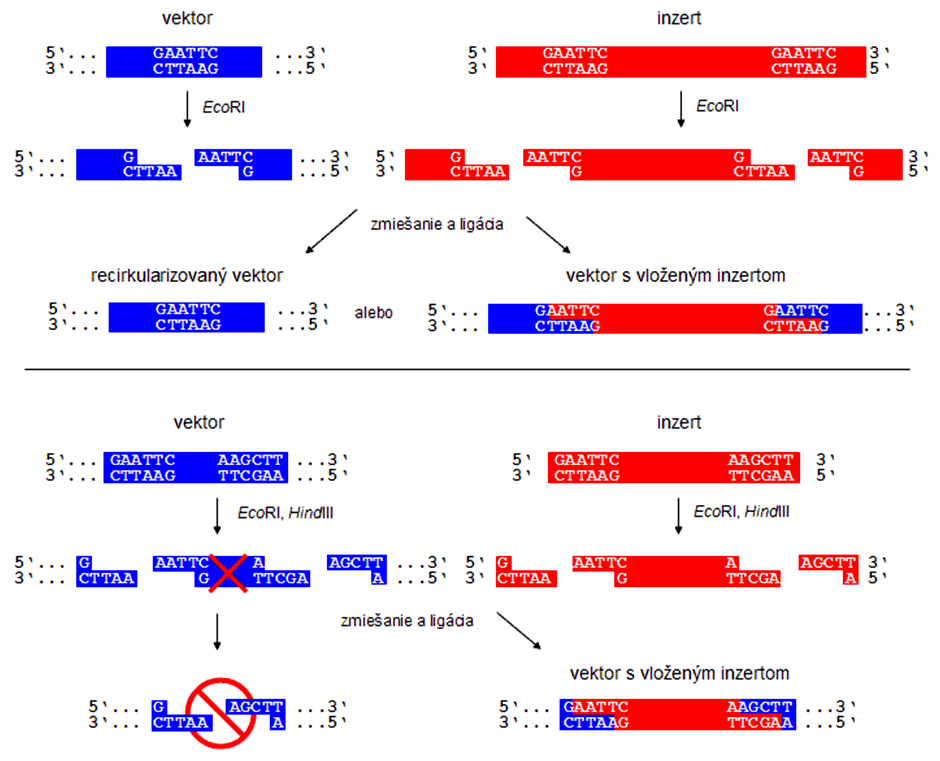
Restrikčné endonukleázy alebo restrikázy sú enzýmy štiepiace DNA v presne definovaných cieľových sekvenciách, tzv. restrikčných miestach. Tie predstavujú zväčša palindromatické sekvencie DNA s párnym počtom rozpoznávacích nukleotidov (4, 6, príp. viac). Palindróm je nukleotidová sekvencia, ktorá sa na komplementárnom vlákne opakuje v presne obrátenom/protismernom poradí nukleotidov. Napr.:
5'...GAA TTC...3'
3'...CTT AAG...5'
Najviac používané restrikčné endonukleázy v molekulárnej biológii štiepia vo vnútri cieľovej sekvencie o dĺžke 4 alebo 6 nukleotidov a vytvárajú tak prečnievajúce (jednovláknové) alebo tupé (dvojvláknové) konce.
Pravdepodobnosť výskytu restrikčného miesta na DNA je štatistická, pričom väčšia je v prípade restrikčných enzýmov rozoznávajúcich 4- ako 6-nukleotidové restrikčné miesta. Restrikčný enzým s názvom EcoRI (izolovaný z Escherichia coli) rozoznáva palindromatickú sekvenciu 5'-GAATTC-3'. Na určitom mieste na DNA môže byť ľubovoľný jeden zo štyroch nukleotidov (A, T, G alebo C). To znamená, že pravdepodobnosť výskytu sekvencie GAATTC (o dĺžke 6 nukleotidov) na DNA je daná číslom 46 = 4096, z čoho vyplýva, že v priemere (!) každé 4 kbp sa nachádza rozpoznávacia sekvencia pre EcoRI. Enzým HhaI (izolovaný z Haemophilus haemolyticus), ktorý rozoznáva 4-nukleotidovú sekvenciu, má restrikčné miesta v priemere každých 256 nukleotidov (44).
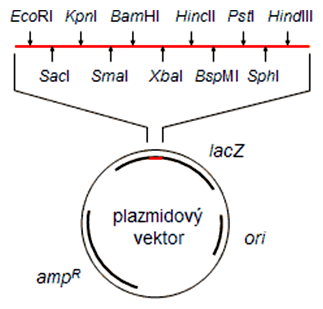
Existuje mnoho komerčne dostupných restrikčných endonukleáz. Vektory sa však často cielene dizajnujú tak, aby obsahovali restrikčné miesta pre najpoužívanejšie enzýmy (EcoRI, HindIII, SacI, BamHI, PstI, KpnI) nahustené za sebou v krátkej oblasti označovanej ako polylinker (alebo z angl. MCS - multi-cloning site). Restrikčné miesto pre niektorý enzým sa pritom vo vektore vyskytuje najviac jedenkrát, čo zabezpečí, že sa vektor po jeho pôsobení len "otvorí" (linearizuje) a nič potrebné sa z neho nevyštiepi.
Klonovanie DNA link
Pod pojmom klonovanie DNA sa rozumie vytváranie mnohých kópií špecifických sekvencií DNA za účelom ďalšieho molekulárno-biologického výskumu (expresia génu a jej regulácia; sekvenovanie - tzn. určovanie primárnej štruktúry, poradia nukleotidov; cielená mutagenéza - tvorba mutácií a štúdium mutantného fenotypu). Klonovanie DNA v zmysle molekulárnej biológie je teda odlišné od klonovania celých organizmov (napr. ovca Dolly).
Klonovanie DNA tak pozostáva z nasledovných krokov:
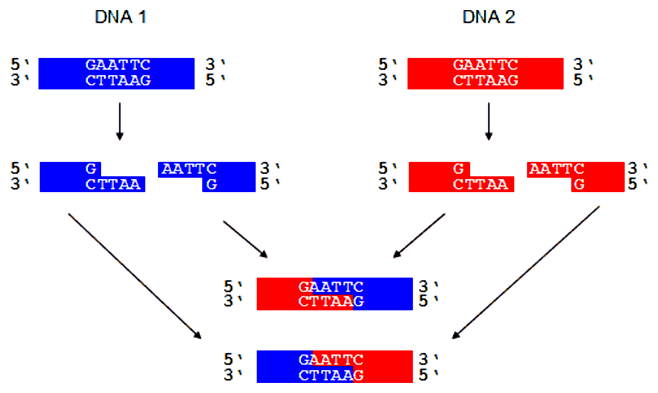
- Izolácia DNA z organizmu, ktorého genetickú informáciu chceme študovať (t.j. izolácia DNA 2 z obrázku vyššie).
- Príprava klonovacieho vektora (DNA 1; tento krok sa v skutočnosti nerobí, pretože biotechnologické firmy zväčša dodávajú hotové vektory).
- Štiepenie donorovej DNA a vektora (DNA 1 + DNA 2) pomocou restrikčných endonukleáz.
- Ligácia fragmentov (inzertu) donorovej DNA s vektorom pomocou enzýmu ligázy (najviac sa používa ligáza z bakteriofágu T4, pomenovaná T4-ligáza).
- Transformácia buniek ligačnou zmesou (obsahujúcou rekombinatné molekuly vektor + inzert). Bunky, resp. bunkové kolónie nesúce rekombinantnú molekuly sa nazývajú všeobecne rekombinanty.
- Selekcia rekombinantov.
- Analýza rekombinantov.
Princíp klonovania DNA v plazmidových vektoroch link
Plazmidy sú kovalentne uzavreté kruhové molekuly, ktoré sa replikujú nezávisle od delenia bakteriálneho chromozómu. Ich veľkosť je v rozmedzí 1-200 kbp. Menšie plazmidy (2-15 kbp) sa efektívnejšie vnášajú do hostiteľských buniek ako plazmidy väčšie. Taktiež menšia DNA je stabilnejšia a spravidla sa v hostiteľovi replikuje do vyššieho počtu. Veľké plazmidy sú často len jednokópiové (napr. F plazmid). Plazmidové klonovacie vektory sa vnášajú do buniek pomocou transformácie.
Plazmidový klonovací vektor pre E. coli musí mať tieto sekvencie:
- Počiatok replikácie (ori, angl. origin = pôvod, začiatok)
- Restrikčné miesto pre restrikčné endonukleázy na vloženie cudzieho DNA fragmentu (polylinker)
- Selekčný marker (napr. gén antibiotikovej rezistencie na ampicilín ampR, tetracyklín tetR, kanamycín kanR atď.)
Transformácia buniek link
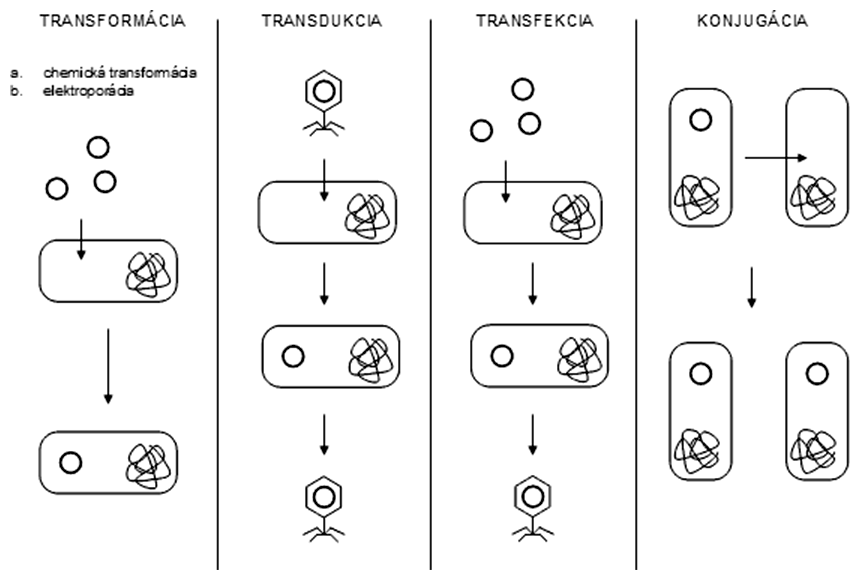
Transformácia je proces, pri ktorom dochádza k zavedeniu cudzej molekuly DNA (novej genetickej informácie) do buniek, a tým bunky získajú nové fenotypové vlastnosti. Transformovať je možné veľké množstvo organizmov vrátane baktérií, kvasiniek, rastlinných a živočíšnych buniek.
Do buniek je možné novú DNA vniesť niekoľkými spôsobmi, ktorými sú:
Transformácia (v užšom zmysle slova) je proces, pri ktorom sa do buniek vnesie plazmidová DNA priamo z roztoku (napr. z ligačnej zmesi).
Transdukcia je spôsob prenosu DNA pomocou vírusov. Rekombinantné bakteriofágy je možné využiť ako vektory na prenos cudzorodej DNA do buniek baktérií. Zvláštnym typom transformácie je transfekcia (spojenie slov transformácia + infekcia), pri ktorej sa transfomuje bunka purifikovanou rekombinantnou vírusovou alebo fágovou DNA (t.j. nie pomocou viriónov), pričom po úspešnej transfekcii sa obnoví virulencia (vytvoria sa plne funkčné vírusové častice).
Na prenos rekombinantných DNA z jednej baktérie do druhej sa môže využiť prirodzený proces - konjugácia. Takto možno DNA preniesť aj do kmeňov, ktoré nie sú priamo transformovateľné, alebo zatiaľ neexistujú účinné metódy na ich transformáciu.
Bunky, ktoré sú schopné prijať cudziu DNA, sa nazývajú kompetentné bunky. Niektoré druhy baktérií (napr. Bacillus subtilis, Streptococcus pneumoniae, Haemophilus influenzae) sú prirodzene kompetentné v niektorých fázach svojho životného cyklu. U iných druhov (napr. Escherichia coli) je možné pripraviť kompetentné bunky opracovaním špeciálnymi roztokmi, príp. sa cudzorodá DNA vnáša pomocou elektrického poľa.
Účinnosť transformácie sa udáva v počte rekombinantov vzniknutých z 1 µg DNA a vyjadruje sa ako jednotka CFU/µg (angl. colony forming units = kolónie formujúce jednotky).
Chemická transformácia link
Základnú metódu na prípravu kompetentných buniek Escherichia coli vyvinuli Mandel a Higa v roku 1970. Princípom metódy je príprava kompetentných buniek opracovaním ľadovým chloridom vápenatým CaCl2, čím sa zmení štruktúra a náboj bunkovej steny. Po inkubácii kompetentných buniek s roztokom rekombinantnej DNA pri 0°C sa bunky vystavia na krátku dobu (50 sek) teplotnému šoku (angl. heat-shock) pri 42°C, čím sa umožní vstup DNA do bunky. Následne sa bunky regenerujú inkubáciou v neselektívnom kultivačnom médiu, aby došlo k zaceleniu bunkovej steny a expresii génov rezistencie na rekombinantnom plazmide. Napokon sa bunky vysejú na selektívne médium s antibiotikom, kde narastú len kolónie rekombinantov, pričom bunky bez rekombinantného plazmidu zahynú vplyvom antibiotika.
Efektívnosť transformácie nezávisí len od spôsobu opracovania E. coli ale aj od ich genotypu. V súčasnej dobe sa v laboratóriách využívajú kmene, ktoré majú zmenenú štruktúru bunkovej steny, a preto sú veľmi dobre transformovateľné.
Maximálna účinnosť chemickej transformácie kmeňov E. coli dosahuje hodnoty 106 – 107 CFU/µg.
Elektroporácia link
Elektroporácia je univerzálna metóda, ktorá sa používa na transformáciu rôznych druhov baktérií, kvasiniek, cicavčích buniek a iných. Pri tejto metóde sa bunky v prítomnosti DNA na krátku dobu vystavia pôsobeniu elektrického poľa s vysokým napätím (cca 10 kV/cm). Pri tomto procese dochádza k vytvoreniu pórov na povrchu a DNA vstupuje cez bunkovú membránu do vnútra buniek. Bunky sa potom regenerujú a vysievajú na selektívne médiá rovnako ako pri predchádzajúcom postupe.
Pre každý typ buniek je možné vypracovať optimálny protokol, ktorý zahŕňa kultiváciu buniek v špeciálnych kultivačných médiách (napr. prítomnosť glycínu inhibuje syntézu bakteriálnej bunkovej steny, a tým zvyšuje účinnosť elektroporácie), vytipovanie optimálnej fázy rastu a správne nastavenie elektroporačného napätia a času. Pri príprave buniek na elektroporáciu je kritické odstránenie iónov z povrchu bakteriálnych buniek, aby sa zabránilo elektrickému výboju. Preto sa bunky niekoľkokrát premývajú deionizovanou vodou.
Účinnosť elektroporácie je vyššia ako pri klasickej chemickej transformácii, v prípade buniek E. coli dosahuje hodnoty 1-5 × 1010 CFU/µg DNA.
Selekcia rekombinantov link
Už pri výbere rekombinantného vektora sa snažíme o to, aby bolo možné jednoducho odlíšiť úspešne transformované bakteriálne kolónie od netransformovaných kolónií, príp. aj kolónií transformovaných "prázdnym" vektorom, tzn. vektorom bez inzertu. Ak je selektívnym markerom gén rezistencie voči antibiotiku, kolónie, ktoré neboli vôbec vektorom transformované, nevyrastú na selektívnom kultivačnom médiu s prídavkom príslušného antibiotika.
Modro-biely skríning link
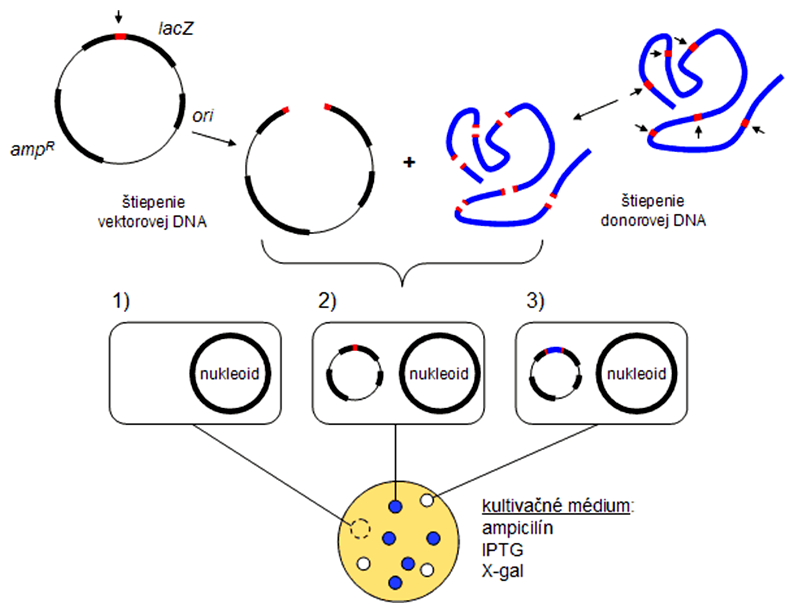
V ďalšom kroku je vhodné odlíšiť kolónie nesúce "prázdny" vektor a rekombinantný vektor s inzertom, čím sa mnohonásobne zvyšuje šanca, že si pre ďalšie analýzy vyberieme správny klon, ktorý nás zaujíma. To sa v prípade baktérií zabezpečuje najčastejšie tak, že restrikčné miesto, resp. polylinker tvorí súčasť génu pre enzým β-galaktozidázu (lacZ). Selekcia rekombinantov založená na využití tohto enzýmu sa nazýva modro-biely skríning a názov má odvodený od dvoch farebne odlíšených typov kolónií, ktoré rastú na selektívnom agarovom médiu.
Po restrikčnom štiepení vektora, tzn. jeho otvorení restrikčným enzýmom v mieste polylinkera, a jeho zmiešaní s fragmentom klonovaného génu (inzertom) s komplementárnymi koncami v ligačnej zmesi môžu nastať dva prípady. Ak sa inzert včlení do vektora, zásadne tým poruší čítací rámec génu lacZ, výsledkom čoho je nefunkčná β-galaktozidáza. Ak sa inzert do vektora nevčlení, dôjde k spätnému "zatvoreniu" (recirkularizácii) vektora, čítací rámec lacZ ostáva neporušený a bunka disponuje funkčným enzýmom β-galaktozidázy.
Modro-biely skríning teda využíva enzymatickú aktivitu enzýmu β-galaktozidázy. Na selektívne agarové médium sa pridajú roztoky dvoch chemických látok: IPTG a X-gal. IPTG (izopropyl-β-D-1-tiogalaktopyranozid) je syntetický derivát laktózy, ktorý je, podobne ako laktóza, induktorom expresie β-galaktozidázy. Na rozdiel od laktózy ho však bunka nevie metabolizovať na glukózu, čo spôsobí permanentnú expresiu β-galaktozidázy (keby sa použil ako induktor laktóza, časom dôjde ku katabolickej represii). X-gal je zas iná syntetická zlúčenina, ktorá sa účinkom β-galaktozidázy rozkladá na produkt farbiaci kolóniu do modra. Z uvedeného vyplýva, že bunky obsahujúce "prázdny" plazmid exprimujú funkčnú β-galaktozidázu a budú tvoriť na miskách s médiom obsahujúcim IPTG a X-gal modré kolónie, zatiaľčo bunky obsahujúce rekombinantný vektor s inzertom s prerušeným čítacím rámcom lacZ budú tvoriť biele kolónie, ktoré nás zaujímajú.
Vektor obsahuje ako selekčný marker gén rezistencie na ampicilín a čítací rámec lacZ, do ktorého je vložený polylinker. Vektorovú molekulu aj molekulu donorovej DNA (cudziu DNA, ktorú chceme klonovať) štiepime osobitne pomocou jedného restrikčného enzýmu (napr. EcoRI), výsledné fragmenty zmiešame a transformujeme nimi baktérie E. coli s nefunkčným enzýmom β-galaktozidázou. Bunky vysievame na médium obsahujúce ampicilín, IPTG a X-gal. Tie, ktoré neboli transformované vektorom (1), postrádajú gén rezistencie na ampicilín, takže na médiu nevyrastú. Bunky s prázdnym vektorom (2) vyrastú a v dôsledku funkčného enzýmu β-galaktozidázy štiepia X-gal na modrú zlúčeninu. Bunky s rekombinantným vektorom (3) budú tvoriť biele kolónie, pretože je u nich porušený čítací rámec pre β-galaktozidázu a X-gal neštiepia.
Asymetrické klonovanie link
Účelom asymetrického klonovania je zabránenie spontánnej recirkularizácii vektora, a tým zvýšenie pravdepodobnosti vzniku rekombinantných molekúl vektor + inzert. Asymetrické klonovanie využíva štiepenie donorovej a vektorovej DNA dvoma restrikčnými enzýmami, ktoré produkujú sekvenčne rozdielne konce. Takéto konce nie sú k sebe komplementárne, a tak nemôže dôjsť k recirkularizácii vektorovej molekuly. Keďže schopnosť transformácie majú len cirkulárne a nie lineárne rekombinantné vektory, je vysoko pravdepodobné, že kolónie, ktoré vyrastú na selektívnom antibiotikovom médiu, obsahujú rekombinantný vektor práve s vloženým inzertom. Asymetrickým klonovaním sa zároveň zabezpečuje vloženie inzertu v správnej orientácii, ktorá môže byť dôležitá pre niektoré experimenty (napr. expresné rekombinantné vektory, kde inzertom je génu exprimovaný ako funkčný proteín).
Analýza rekombinantov link
Napriek tomu, že došlo k selekcii rekombinantov na médiu s antibiotikom a po modro-bielom skríningu sme selektovali biele kolónie, môžu sa inzerty v rekombinantných vektoroch z rôznych bunkových klonov odlišovať. Na potvrdenie správnej sekvencie inzertu alebo identifikáciu neznámych inzertov v rekombinantných plazmidoch existujú rôzne techniky ich analýzy. Sú to teda rôzne metódy na hľadanie konkrétnych sekvencií DNA (génov) spomedzi viacerých klonov (bunkových kolónií), ktoré nesú rôzne rekombinantné molekuly DNA. Medzi metódy analýzy rekombinantov patria:
- identifikácia inzertu pomocou špecifických PCR primerov
- identifikácia pomocou restrikčného štiepenia
- hybridizácia so sondami so známou sekvenciou
- sekvenovanie DNA
- imunochemické metódy detekcie prítomnosti exprimovaných proteínov (expresné vektory)
- detekcia fenotypových znakov (expresné vektory)