Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Kvantitatívna PCR (real-time PCR). [cit. 2024-04-20]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/kvantitativna-pcr-real-time-pcr>.
Metóda kvantitatívnej real-time PCR je variáciou štandardnej laboratórnej techniky polymerázovej reťazovej reakcie (PCR) s možnosťou kvantifikácie (merania množstva DNA) vznikajúceho PCR produktu (amplikónu) po každom cykle, čiže "za behu" (angl. real-time). Špeciálny termálny cyklér s detektorom fluorescencie meria buď zväčšujúce sa množstvo dvojvláknovej DNA v reakčnej zmesi (SYBR Green I) alebo množstvo značky hybridizujúcej k cieľovej sekvencii amplikónu (TaqMan). Práve z dôvodu kvantifikácie DNA v reakčnej zmesi možno spätne vyrátať počiatočné množstvo templátovej DNA vo vzorke (napr. množstvo vírusu v tkanive), alebo zistiť relatívne množstvo DNA jednej vzorky vzhľadom na inú (napr. či je v tkanive po liečbe menej vírusu ako pred liečbou). Kvantitatívna real-time PCR sa označuje skratkou qPCR (angl. quantitative PCR = kvantitatívna PCR).(1)(2)(3)(4)
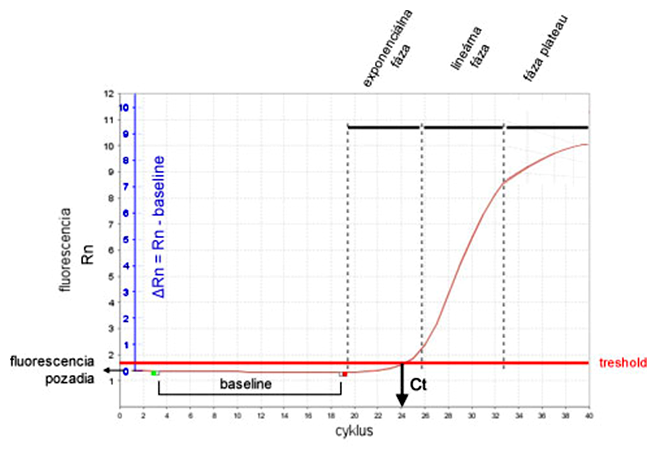
Grafický priebeh qPCR reakcie link
Priebeh kvantitatívnej real-time PCR (skrátene qPCR) graficky znázorňuje amplifikačná krivka (angl. amplification plot). Amplifikačná krivka je závislosťou hladiny detegovanej fluorescencie (os y) a času, resp. cyklu (os x). Každá qPCR sa skladá z nasledovných 4 fáz:
- exponenciálna fáza - dochádza k zdvojnásobeniu množstva amplikónu po každom cykle
- lineárna fáza - zložky reakcie (primery, dNTP) sa spotrebúvajú na neúmerne narastajúce množstvo amplikónu, čím sa reakcia spomaľuje
- fáza plateau (čítaj 'plató') - množstvo amplikónu sa už nazväčšuje, pretože sa spotrebovali primery alebo dNTP, naopak, amplikóny sa začínajú rozpadať
Dĺžka PCR produktu pri qPCR by nemala presiahnuť 400 bázových párov (bp), ale kratšie amplikóny dávajú lepšie výsledky, pretože PCR je efektívnejšia (optimálna dĺžka je 50-150 bp).
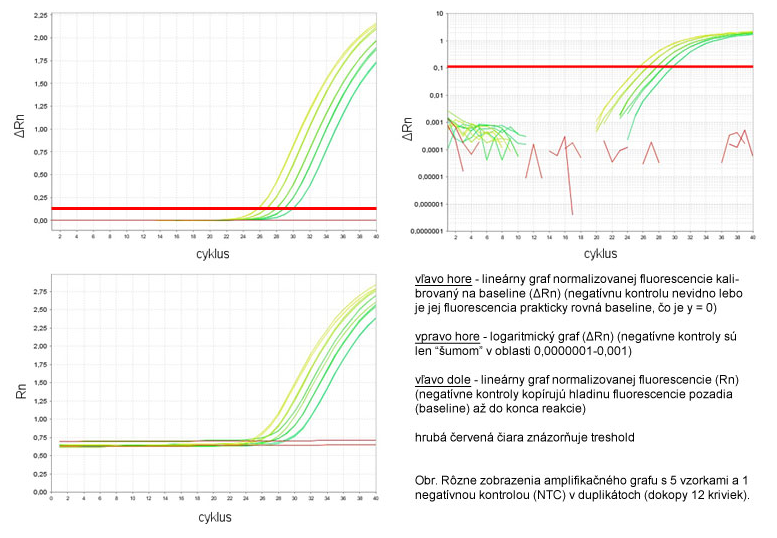
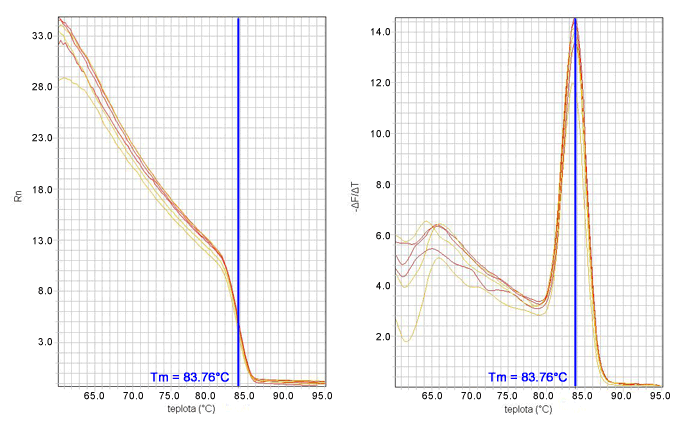
Fluorescencia na osi y sa označuje ako normalizovaná fluorescencia (Rn), pretože je to nameraná fluorescencia (SYBR Green I alebo fluorescencia reportéra - TaqMan) normalizovaná na objem reakčnej zmesi (pozri ROX). Počas prvých cyklov qPCR (zvyčajne od 3 do 15) možno pozorovať veľmi nízke zmeny v detegovanej fluorescencii. Táto nízka hladina má svoje anglické pomenovanie baseline a zodpovedá základnej fluorescencii pozadia alebo tzv. "šumu". Tento šum môžeme od skutočnej fluorescencie amplikónu odrátať a korigovať tak všetky amplifikačné krivky, aby začínali na hodnote y = 0. Táto korekcia sa môže vyjadriť rovnicou Rn - baseline = ΔRn]].
Pre qPCR je práve kritický bod, resp. cyklus, v ktorom začína exponenciálna fáza, pretože vtedy množstvo amplikónu najlepšie odzrkadľuje vstupné množstvo templátovej DNA. Tento cyklus, kedy termálny cyklér zaznamená začiatok exponenciálnej fázy PCR, nazýva sa prahový cyklus a označuje sa Ct (angl. treshold cycle) alebo Cp (angl. crossing point). Čím menšia hodnota Ct, tým väčší počet kópií templátovej DNA bolo na začiatku reakcie. Pre výsledok qPCR predstavujú hodnoty Ct hlavný údaj, s ktorým sa pracuje vo výpočtoch. Hodnota fluorescencie v tomto mieste má svoje anglické pomenovanie treshold.
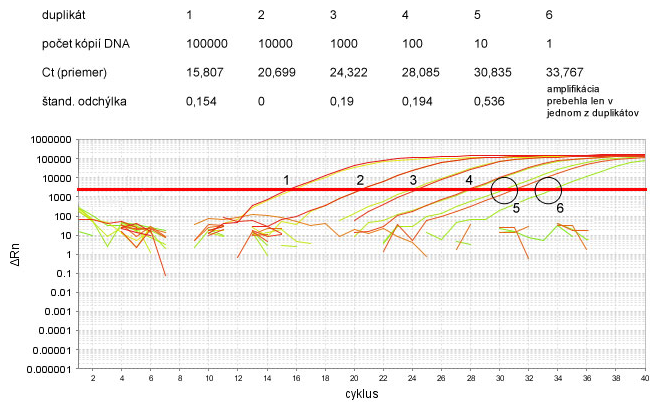
Keďže údaj Ct je meraný až na 8 desatinných miest (Applied Biosystems) a, najmä v neskorších cykloch, aj malé rozdiely v Ct značia veľký rozdiel v počte kópií DNA, je dôležité, aby bola jeho presnosť overená aspoň dvomi nezávislými meraniami. Inak povedané, každá vzorka, analyzovaná prostredníctvom qPCR, by sa mala na platničky napipetovať v duplikátoch, t.j. do dvoch samostatných jamiek. Medzi Ct hodnotami jednotlivých duplikátov musí byť nízka štandardná odchýlka (0-0,167), aby ich bolo možné s kľudným svedomím spriemerovať.
Vysokú odchýlku spôsobujú najčastejšie:
- nepresné pipetovanie
- veľmi nízka koncentrácia templátovej DNA (a z toho vyplývajúce vysoké hodnoty Ct > 30)
- prítomnosť inhibítorov
ROX link
ROX je označenie pasívnej referenčnej fluorescenčnej farbičky, ktorá sa môže pridať do niektorých qPCR reakčných zmesí (cykléry od Applied Biosystems, Stratagene). Je to inertná farbička, ktorá slúži na normalizáciu niektorých chýb zapríčiňujúcich vysokú štandardnú odchýlku medzi duplikátmi (najmä nepresné pipetovanie), pretože hladina fluorescencie ROX je priamo úmerná jej množstvu, a teda objemu reakčnej zmesi. Excitačné maximum je cca 575 nm, emisné maximum je cca 600 nm. Normalizovaná fluorescencia (Rn) taktiež zohľadňuje prítomnosť ROX v reakčnej zmesi.
Metódy detekcie fluorescencie v qPCR link
Z hľadiska detekcie fluorescenčného signálu rozlišujeme 2 najbežnejšie metódy:
- SYBR Green I (čítaj 'sajbr grín')
- TaqMan (čítaj 'takman')
SYBR Green I link
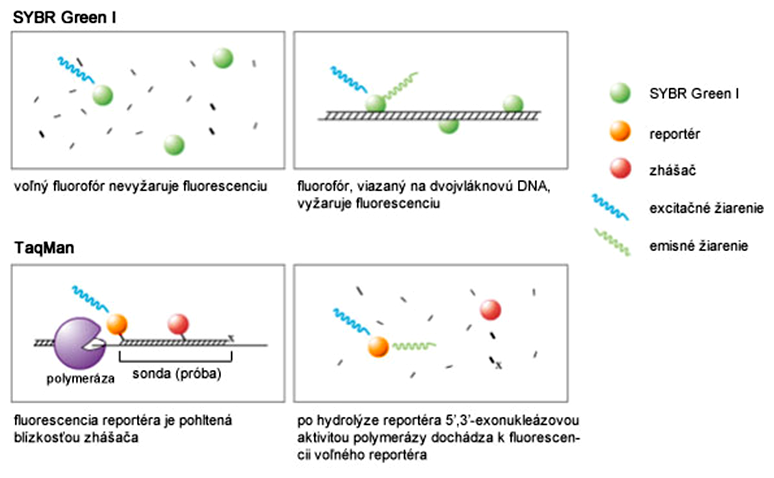
SYBR Green I je fluorescenčné farbivo, ktoré sa nešpecificky viaže na dvojvláknovú DNA. Excitačné maximum SYBR Green I je v oblasti modrého svetla s vlnovou dĺžkou 497 nm a emisné maximum je v oblasti zeleného svetla s vlnovou dĺžkou 520 nm. SYBR Green I sa pridáva do bežnej qPCR reakčnej zmesi. Samotná farbička sa stáva fluorescenčne "aktívnou" len vtedy, keď je naviazaná na dvojvláknovú DNA, ktorou je PCR produkt. Termálny cyklér po každom cykle excituje molekuly SYBR Green I modrým svetlom a následne zaznamená množstvo emitovaného zeleného svetla, ktoré odzrkadľuje množstvo PCR produktu.
Výhodou tejto metódy je relatívne nízka cena a jednoduchosť. Ale jednoduchosť môže byť aj nevýhodou. Keďže táto metóda deteguje prítomnosť akejkoľvej dvojvláknovej DNA, "pozitívny signál" budú dávať aj nešpecifické amplikóny a primer diméry.
Krivka topenia link
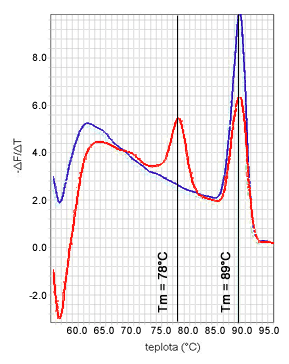
Keď hovoríme o špecificite qPCR, treba spomenúť krivku topenia (angl. melting curve, dissociation curve). Teplota topenia (Tm) amplikónu je analogická teplote topenia primeru, čo je taká teplota, pri ktorej je 50% primeru v jednovláknovej forme a 50% je viazaného na DNA. Analogicky, teplota topenia amplikónu je teplota, pri ktorej sa polovica amplikónu denaturuje na jednoreťazcové vlákna. Táto teplota je závislá od sekvencie, t.j. bázového zloženia a dĺžky amplikónu. Z toho vyplýva, že pomocou teploty topenia vieme určiť prítomnosť špecifického amplikónu v reakčnej zmesi.
Krivka topenia v real-time PCR je grafické vyjadrenie množstva nameranej fluorescencie v reakčnej zmesi v závislosti od zmeny teploty topenia. Zisťuje sa až na konci samotnej qPCR tak, že sa postupne deteguje fluorescencia z dvojvláknovej DNA (s naviazaným SYBR Green I) pri rôznej teplote, narastajúcej napr. o 1°C pred každým meraním fluorescencie. So stúpajúcou teplotou klesá množstvo detegovanej fluorescencie, pretože je čoraz viac DNA denaturovanej na jednovláknové reťazce. Výsledná krivka je softvérom upravená tak, aby bolo možné jasne zaznamenať dynamiku zmien fluorescencie vzhľadom na teplotu.
Ak má teplota topenia špecifického amplikónu hodnotu 89°C (teoreticky sa dá vypočítať, ak poznáme jeho sekvenciu), zisťuje sa teplota topenia v rozmedzí 60-95°C. Softvér termálneho cykléra zostrojí krivku topenia, ktorá by mala mať jedno maximum pri hodnote 89°C (modrá krivka na obrázku). Ak sú však na krivke prítomné dve maximá, jedno pri 89°C a druhé pri nižšej teplote (napr. 78°C), znamená to prítomnosť primer diméru alebo nešpecifického amplikónu (červená krivka na obrázku). V tom prípade nie je celkové množstvo fluorescencie príslušnej vzorky, nameranej po každom cykle, ekvivalentné množstvu špecifického amplikónu a výsledok (Ct hodnotu) nemožno považovať za dôveryhodný. Ďalším charakteristickým znakom tejto situácie môže byť efektivita qPCR (E) vyššia ako 100% (viď nižšie).
TaqMan link
Metóda detekcie TaqMan využíva oligonukleotidy s dĺžkou 18-30 báz, ktoré sú komplementárne k nejakej vnútornej sekvencii špecifického amplikónu, ktorý vzniká pri qPCR. Sú to v podstate hybridizačné sondy (próby), ktoré sú na oboch koncoch značené špeciálnymi fluorescenčnými farbičkami. Ak sú prítomné obe farbičky, fluorescencia je inhibovaná, pretože emisné žiarenie jednej farbičky je pohltené druhou farbičkou, nachádzajúcou sa v jej blízkosti, a teda neprechádza do detektora fluorescencie termálneho cykléra. V literatúre sa tieto farbičky označujú pojmom reportér (angl. reporter) a zhášač (angl. quencher). Ak však dôjde k odštiepeniu reportéra z TaqMan próby, jeho fluorescencia nie je viac inhibovaná a zaznamená sa.
Z uvedeného vyplýva, že meranie fluorescencie vyžaduje použitie DNA-polymerázy s 5',3'-exonukleázovou aktivitou. Próba s oboma farbičkami hybridizuje k špecifickému úseku vo vnútri amplikónu. Ak naň nasadne primer, polymeráza začne z voľných dNTP syntetizovať komplementárne vlákno v smere 5'-3'. Ak na tejto ceste narazí na próbu, začne z nej postupne odštepovať nukleotidy a taktiež molekulu reportéra, čím sa táto dostane spod vplyvu zhášača a deteguje sa fluorescencia. Postupné zväčšovanie množstva fluorescencie voľnej reportérovej farbičky sa vyhodnotí ako množstvo vzniknutého amplikónu.
Výhodou tejto metódy oproti SYBR Green I je práve špecificita daná sekvenciou próby. Ak by aj dochádzalo k tvorbe nešpecifických amplikónov, tým, že na ne nenasadajú TaqMan próby, nevydávajú fluorescenciu. Pomocou TaqMan prób je možné detegovať a kvantifikovať viacero rozdielnych amplikónov pomocou prób s rozdielnymi fluorescenčnými farbičkami (multiplex real-time PCR). Nevyhódou tejto metódy je jej vyššia cena oproti SYBR Green I, ako aj pomerne prísne požiadavky na sekvenciu TaqMan próby.
Absolútna kvantifikácia link
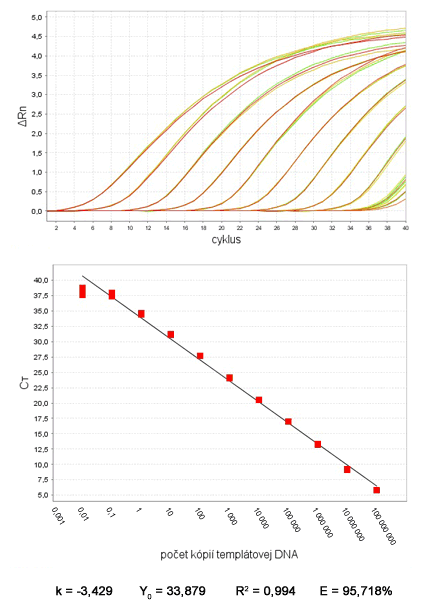
Absolútna kvantifikácia je spôsob kvantifikácie vstupného množstva DNA v qPCR vyjadreného v absolútnych číslach, najčastejšie v počte kópií alebo nanogramoch. Využíva sa k tomu prirovnanie Ct hodnôt testovaných vzoriek k Ct hodnotám tzv. štandardy, ktorej vstupné množstvo je presne známe. Štandarda je sériovo nariedená vzorka DNA so známou koncentráciou alebo počtom kópií. Býva ňou veľmi často rekombinantná plazmidová DNA s klonovaným génom, resp. PCR produktom, ktorý sa počas qPCR amplifikuje.
Z Ct hodnôt štandardy prístroj zostrojí kalibračnú krivku (angl. standard curve), ktorá znázorňuje závislosť Ct hodnôt (os y) od koncentrácie DNA (počet kópií alebo hmotnosť DNA v nanogramoch), vyjadrenej v logaritmickej mierke (os x). Z dôvodu logaritmickej mierky koncentrácie štandardy je kalibračná krivka vlastne priamka. Kalibračná krivka obsahuje aspoň 5-7 bodov, t.j. 5-7 vzoriek s rôznou koncentráciou štandardy.
Parametre kalibračnej krivky link
Kalibračnú krivku charakterizuje niekoľko parametrov:
Korelačný koeficient link
Korelačný koeficient (R2) udáva linearitu bodov kalibračnej krivky, t.j. presnosť, s akou namerané hodnoty Ct štandardy pasujú do lineárneho priebehu krivky (optimálne R2 = 0,99-1).
Priesečník osi y link
Y0, alebo z angličtiny y-intercept, je priesečník kalibračnej krivky s osou y. Udáva Ct hodnotu, ktorá zodpovedá amplifikácii 1 kópie templátovej DNA v danej qPCR. Je to teoretický limit citlivosti real-time PCR, avšak prakticky často nie je možné amplifikovať tak nízke množstvo DNA. Tento údaj môže poslúžiť na porovnanie citlivosti v prípade rôznych podmienok analýzy (iné primery, nastavenie qPCR programu).
Smernica a efektivita link
Smernica (k) (angl. slope) vyjadruje účinnosť (efektivitu) qPCR. Medzi smernicou a účinnosťou (E), vyjadrenou v percentách, je nasledovný vzťah:
k = -log (E + 1)
E = 10-1/k - 1
pričom platí, že k = -3,32 je rovné E = 1 (100%). Povolené hodnoty účinnosti sú E = 0,9-1,1 (90-110%) (k = -3,58 až -3,10). Ideálne by efektivita qPCR mala byť 100%, čo znamená, že počas polymerizačného kroku dochádza k amplifikácii každej molekuly DNA. Prakticky je však efektivita reakcie nižšia. Hodnota efektivity nad 100% môže značiť prítomnosť nešpecifických amplikónov, príp. primer dimérov. Príliš nízka efektivita (<90%) je cenná informácia o priebehu qPCR.
Efektivitu qPCR ovplyvňujú:
- dĺžka amplikónu
- sekundárna štruktúra amplikónu
- množstvo GC párov amplikónu
- nevhodná koncentrácia reakčných zložiek
- dizajn primerov
- nízka kvalita DNA-polymerázy
Relatívna kvantifikácia link
Relatívna (komparatívna) kvantifikácia predstavuje taký spôsob kvantifikácie templátovej DNA neznámych vzoriek, kedy nás nezaujíma ani tak jej absolútne množstvo, ale rozdiel v množstve oproti nejakej kontrolnej, biologickej vzorke - kalibrátoru. Kalibrátor je skrátka taká vzorka, ktorá predstavuje východiskový stav nášho experimentu, voči ktorej zisťujeme zmeny (napr. vplyv liečby na pokles množstva vírusu oproti neliečenému pacientovi). Na relatívnu kvantifikáciu nie je potrebná kalibračná krivka.
qRT-PCR link
Relatívna kvantifikácia väčšinou zahŕňa experimenty študujúce génovú expresiu, takže templátom do qPCR je RNA prepísaná do podoby komplementárnej DNA - cDNA (angl. complementary DNA). Kvantifikácia génovej expresie je tak väčšinou dvojkroková metóda, kde samotnej qPCR predchádza reverzná transkripcia, a metóda sa preto označuje ako qRT-PCR (angl. quantitative reverse transcriptase PCR). Kalibrátor býva najčastejšie cDNA z tkaniva pred liečbou, alebo v prípade časovo-závislej hladiny expresie génu (napr. 0-48 hod) je ním cDNA z času 0, atď.
V prípade, že sme sa rozhodli relatívne kvantifikovať hladinu expresie určitého génu, nestačí nám výsledok jednej qRT-PCR. Problém je v tom, že nikdy nevieme, koľko templátovej cDNA sme v skutočnosti do qPCR pridali. Z toho vyplýva, že zistená zmena v hladine expresie dvoch vzoriek môže byť jednoducho spôsobená rôznou koncentráciou vstupnej cDNA, a nie skutočným rastom či poklesom génovej expresie. V takom prípade je potrebná ešte jedna RT-qPCR reakcia, tzv. endogénna kontrola, v ktorej budeme amplifikovať cDNA referenčného génu (tzv. "house-keeping" gén), ktorého hladina expresie je za každých podmienok rovnaká (napr. beta-aktín, tubulín, ubikvitín, histón H3 a pod.). Až potom musíme spraviť tzv. normalizáciu na množstvo expresie referenčného génu, čím dostaneme skutočnú mieru expresie daného génu, ktorý nás zaujíma.
Analýza dát link
Výsledkom relatívnej kvantifikácie testovanej vzorky cDNA je v podstate jednoduchý číselný údaj - relatívna kvantita (RQ), ktorý hovorí o tom, koľkokrát je hladina génovej expresie nižšia alebo vyššia oproti kontrolnej vzorke - kalibrátoru. Nepracujeme so žiadnymi presnými kópiami templátovej DNA, resp. cDNA. Nemusíme pracovať ani s kalibračnou krivkou, ale môže sa hodiť v prípade, že sa efektivita qPCR na referenčný house-keeping gén výraznejšie odlišuje od efektivity qPCR na gén, ktorého expresia nás zaujíma.
Základný algoritmus link
V najjednoduchšej forme možno hladinu expresie génu vyjadriť ako rozdiel hodnôt Ct testovanej vzorky (CtSAMP) a kalibrátora (CtCAL):
CtSAMP - CtCAL = ΔCt
Rozdiel v génovej expresii (RQ) je potom jednoducho daný vzorcom:
RQ = 2ΔCt
Príklad: Ak je CtSAMP = 10 a CtCAL = 5, tak RQ = 2(10-5) = 25 = 32, čo predstavuje 32-násobné zníženie hladiny expresie testovanej vzorky oproti kalibrátoru.
V praxi sa tento jednoduchý spôsob nepoužíva, pretože nezohľadňuje normalizáciu voči referenčnému génu ani efektivitu qPCR.
Normalizácia na referenčný gén link
Tento spôsob komparatívnej analýzy qPCR dát je populárny, pretože okrem kalibrátora (CtCAL) zahŕňa aj základnú normalizáciu na referenčný gén (CtREF). Samozrejme, ako kalibrátor tak aj testovaná vzorka (CtSAMP), majú svoju vlastnú prislúchajúcu hodnotu CtREF, označím ich preto ako CtCALREF a CtSAMPREF:
CtSAMP - CtSAMPREF = ΔCtSAMP
CtCAL - CtCALREF = ΔCtCAL
Potom sa od normalizovanej ΔCtSAMP hodnoty vzorky odráta normalizovaná ΔCtCAL hodnota kalibrátora, čím dostaneme obdobný vzorec, ako v prípade prvého algoritmu:
ΔCtSAMP - ΔCtCAL = ΔΔCt
Rozdiel v génovej expresii (RQ) je:
RQ = 2-ΔΔCt
Tento vzorec predpokladá 100% účinnosť qPCR.
Príklad: Rozdielna expresia génu X pravdepodobne zapríčiňuje genetické ochorenie. Boli odobraté vzorky RNA od pacientov trpiacich týmto ochorením a od zdravých dobrovoľníkov (kontrola). Obidve vzorky boli podrobené qRT-PCR s normalizáciou na endogénnu kontrolu - histón H3. Priemerné Ct hodnoty duplikátov pre oba gény sú uvedené v tabuľke. Ako sa líši hladina expresie v týchto dvoch skupinách ?
| gén X (CtX) | histón H3 (CtH3) | |
| pacienti | 30 | 25 |
| kontrola | 33 | 26 |
| efektivita qPCR | 100% | 100% |
Normalizácia na referenčný gén:
ΔCtPACIENTI = ΔCtPACIENTIX - ΔCtPACIENTIH3 = 30 - 25 = 5
ΔCtKONTROLA = ΔCtKONTROLAX - ΔCtKONTROLAH3 = 33 - 26 = 7
Relatívna kvantifikácia:
ΔΔCt = ΔCtPACIENTI - ΔCtKONTROLA = 5 - 7 = -2
RQ = 2-ΔΔCt = 4
Odpoveď: U pacientov je 4-násobné zvýšenie hladiny expresie génu X.
Efektivita qPCR link
Niekedy aj malý rozdiel v účinnosti qPCR medzi sledovaným a referenčným génom môže dramaticky zmeniť výsledný pomer RQ. Vtedy je súčasťou qPCR aj kalibračná krivka, jednak pre gén záujmu a jednak pre referenčný gén, aby sme z ich smerníc zistili efektivitu qPCR. V tom prípade treba do vzorca zarátať efektivitu qPCR sledovaného génu (ESAMP) a referenčného génu (EREF):
RQ = (ESAMP + 1)ΔCtSAMP / (EREF + 1)ΔCtREF
ΔCtSAMP = CtCAL - CtSAMP
ΔCtREF = CtCAL - CtREF
Príklad: Rozdielna expresia génu X pravdepodobne zapríčiňuje genetické ochorenie. Boli odobraté vzorky RNA od pacientov trpiacich týmto ochorením a od zdravých dobrovoľníkov (kontrola). Obidve vzorky boli podrobené qRT-PCR s normalizáciou na endogénnu kontrolu - histón H3. Efektivita obidvoch qPCR bola preverená pomocou kalibračných kriviek. Priemerné Ct hodnoty duplikátov pre oba gény a efektivity qPCR sú uvedené v tabuľke. Ako sa líši hladina expresie v týchto dvoch skupinách ?
| gén X (CtX) | histón H3 (CtH3) | |
| pacienti | 30 | 25 |
| kontrola | 33 | 26 |
| efektivita qPCR | 80% | 90% |
RQ = (ESAMP + 1)ΔCtSAMP / (EREF + 1)ΔCtREF
RQ = (0,8 + 1)33-30 / (0,9 + 1)26-25
RQ = 1,83 / 1,91
RQ = 5,862 / 1,9
RQ = 3,07
Odpoveď: U pacientov je cca 3-násobné zvýšenie hladiny expresie génu X, berúc do úvahy efektivitu qPCR reakcie.
| problém | možný dôvod problému | riešenie |
| vysoké pozadie fluorescencie alebo fluorescencia v prvých cykloch vyššia ako na konci reakcie | príliš mnoho templátovej DNA | nariediť templát, manuálne nastaviť baseline a treshold |
| amplifikácia nie je exponenciálna | možná prítomnosť inhibítorov | nariediť templát |
| Ct duplikátov sa výrazne odlišuje | nepresné pipetovanie, veľmi nízka koncentrácia templátu - vysoké hodnoty Ct > 30, prítomnosť inhibítorov, nižšia koncentrácia ROX ako odporúčaná zvyšuje štand. odchýlku | zopakovať reakciu, použiť vyššie koncentrácie štandardy (viac ako 100-1000 kópií), skontrolovať krivku topenia, použiť triplikáty, použiť správny mastermix |
| nedošlo k amplifikácii žiadnej vzorky | zlyhanie polymerázy, degradácia templátovej DNA/cDNA, degradácia sondy (TaqMan) | skontrolovať expiráciu polymerázy, chemikálie, použiť novo-nariedenú štandardu, vylúčiť zlyhanie sondy (TaqMan) - test s DNázou - alebo zopakovať so SYBR Green I |
| smernica kalibračnej krivky je nižšia ako -3,3, efektivita qPCR je nízka | chyba pipetovania, degradácia alebo kontaminácia templátu | pripraviť čerstvú štandardu |
| smernica kalibračnej krivky je vyššia ako -3,3, efektivita qPCR je privysoká | chyba pipetovania alebo riedenia štandardy, nešpecifická amplifikácia | nová reakcia, kontrola krivky topenia, optimalizácia PCR, návrh nových primerov |
| amplifikačný graf vyzerá zvláštne | príliš mnoho templátu, chybné nastavenie baseline | nariediť templát, nastaviť baseline manuálne pre každú vzorku (reakciu), vylúčiť cykly s abnormálnou fluorescenciou |
| nemožno nariediť štandard na nižšiu koncentráciu | kontaminácia DNA | skontrolovať negatívnu kontrolu (kontrolu bez templátu), nariediť nový templát |
- Mgr. Marta Elsheimer: Kvantitativní real-time PCR. Výzkumný ústav veterinárního lékařství, Brno.
- Mgr. Gabriela Repiská: Kvantitatívna real time PCR. Ústav molekulárnej biomedicíny LF UK, Bratislava.
- Real-time PCR: Understanding Ct
- Anglický slovník pojmov súvisiacich s kvantitatívnou real-time PCR