Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Vektory v molekulárnej biológii. [cit. 2024-04-19]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/vektory-v-molekularnej-biologii>.
Vektor v molekulárnej biológie je molekula nukleovej kyseliny, ktorá slúži na dopravenie a replikáciu rekombinantnej DNA v hostiteľskom organizme. Vektory využívané v molekulárnej biológii možno členiť podľa viacerých kritérií.
Podľa účelu využitia:
- klonovacie vektory - klonovanie, t.j. zmnoženie kópií rekombinantnej DNA
- expresné vektory - expresia rekombinantného génu, najčastejšie kódujúceho proteín, za výskumným alebo komerčným účelom
- špecializované vektory - napr. cielená tvorba mutácií
- multifunkčné vektory
Podľa hostiteľského organizmu, v ktorom dochádza k ich replikácii:
- bakteriálne vektory - najčastejšie Escherichia coli, Bacillus subtilis a pod.
- kvasinkové vektory - Saccharomyces cerevisiae, Pichia pastoris a pod.
- živočíšne vektory - cicavčie bunky, hmyzie bunky
- rastlinné vektory - hlavne Agrobacterium tumefaciens, Ti plazmidy
- dvojfunkčné vektory - schopné replikácie v rôznych organizmoch, napr. v baktériách aj kvasinkách
Podľa spôsobu replikácie:
- plazmidové vektory
- fágové vektory
- bakteriálne umelé chromozómy (BAC)
- kvasinkové umelé chromozómy (YAC)
Dvojfunkčné vektory link
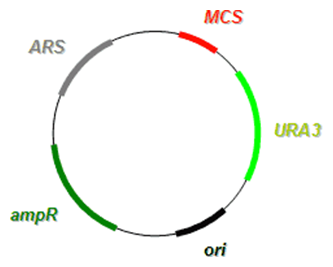
Dvojfunkčné vektory majú schopnosť replikovať sa v dvoch typoch hostiteľských organizmov (baktérie a kvasinky; alebo živočíšne a rastlinné bunky). V anglickej literatúre sa pre tento typ vektorov používa pomenovanie shuttle vektory (čítaj 'šatl vektory'; angl. shuttle = pendlovať medzi dvoma miestami). Plazmidové shuttle vektory, ktoré sa replikujú v prokaryotoch a eukaryotoch, obsahujú tieto sekvencie:
- Počiatok replikácie (ori) v hostiteľskom prokaryotickom organizme.
- Sekvenciu pre replikáciu v eukaryotickom organizme (napr. v kvasinkách) - označuje sa ako ARS (angl. autonomously replicating sequence = autonómne sa replikujúca sekvencia).
- Oblasť pre inzerciu cudzej DNA - polylinker (MCS; angl. multi-cloning site).
- Prokaryotický selekčný marker (napr. gén antibiotikovej rezistencie na ampicilín ampR alebo tetracyklín tetR).
- Eukaryotický selekčný marker (najčastejšie nutričný marker pre syntézu esenciálnej látky, napr. gén URA3 pre syntézu uracilu v auxotrofných kvasinkových ura3 mutantoch).
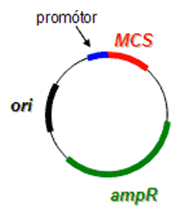
Expresné vektory link
Expresné vektory sú špeciálnym typom vektorov, kde polylinker sa nachádza za regulačnou oblasťou silného promótora, následkom čoho je vložená oblasť cudzej DNA exprimovaná, t.j. prepísaná do mRNA a preložená do proteínu. Expresné vektory sú zväčša derivované z plazmidových klonovacích vektorov. Modifikácie plazmidov spočívajú v pridaní hostiteľsky špecifickej promótorovej sekvencie, transkripčného terminačného signálu a ostatných sekvencií, obzvlášť keď chceme exprimovať eukaryotický gén v prokaryotickom organizme (pridanie Shine-Dalgarnovej sekvencie pre rozoznanie eukaryotickej mRNA prokaryotickým ribozómom a pod.).
Fágové vektory link
Fágové vektory predstavujú bakteriofágy, ktoré ako genetickú informáciu nesú rekombinantnú DNA. Infikujú bakteriálne bunky, do ktorých sa DNA dostáva procesom transdukcie. V baktériách nastáva replikácia (klonovanie) fágovej DNA a tvorba fágových častíc. V tomto zmysle predstavujú rekombinantné fágy klonovacie vektory. Súčasťou životného cyklu fágov je degradácia buniek (lýza) a uvoľnenie vírusových častíc do okolitého prostredia, ktoré sú potom schopné napádať ďalšie hostiteľské bunky. Rekombinantná DNA sa potom izoluje z tzv. plakov, čo sú okrúhle zlyzované plochy na Petriho miskách s kultivačným médiom, na ktorej bunkové kolónie infikované fágom tvoria súvislú vrstvu. Jeden plak predstavuje klonové potomstvo DNA jednej fágovej častice.
Najlepšie preskúmané a najviac používané sú fágové vektory odvodené od bakteriofágu λ (lambda). Môžu nimi byť ako klonovacie tak aj expresné vektory. Pre špeciálne účely (napr. sekvenovanie DNA) sa môžu využívať klonovacie vektory odvodené od fágu s označením M13, ktoré produkujú jednovláknovú DNA. Ich kapacita je však dosť nízka (do 1 kbp).
Životný cyklus fágu λ link
Fág λ (lambda) je najkompletnejšie preštudovaný biologický systém. Virión je tvorený hlavičkou v tvare dvadsaťstenu a proteínovým chvostíkom, cez ktorý prechádza DNA fága pri infekcii hostiteľskej bakteriálnej bunky. Jeho genóm je kompletne osekvenovaný (má 48502 bp), obsahuje lineárnu dvojvláknovú DNA. Po vstupe do bakteriálnych buniek sa λ-DNA cirkularizuje, tzn. spojí sa pomocou krátkych prečnievajúcich koncov na oboch stranách lineárnej molekuly (cez tzv. cos-miesta) do kruhovej molekuly pomocou bunkového enzýmu DNA-ligázy. V tomto stave môže vírus spustiť jeden z dvoch alternatívnych programov:
- Lytický cyklus - spočíva v nasledovných krokoch:
- replikácia vírusovej DNA,
- syntéza obalových proteínov (hlavička, chvostík),
- nabaľovanie fágovej DNA do hlavičky a skladanie kompletných vírusových častíc,
- lýza bunky, z ktorej sa uvoľní približne 100 fágových potomkov schopných ďalšej infekcie.
- Lyzogénny cyklus - pomocou miestne špecifickej rekombinácie sa fágová DNA vsunie na konkrétne miesto bakteriálneho chromozómu hostiteľa. Takéto štádium fága sa nazýva profág. Replikácia fágovej DNA nastáva len súčasne s replikáciou bakteriálnej DNA, ktorej je súčasťou. Fágová DNA teda ostáva v každej bunke len v jednej kópii. Na určitý impulz (napr. hladovanie baktérií, UV-žiarenie) dôjde k uvoľneniu (excízii) fágovej DNA z bakteriálneho genómu a nastáva lytický cyklus zložený z horeuvedených fáz.
- infekcia baktérie fágovou časticou a injekcia fágovej DNA do bunky
- cirkularizácia fágovej DNA cez cos-miesta
- integrácia fágovej DNA do bakteriálneho genómu
- štádium profága, replikuje sa spolu s bakteriálnym chromozómom
- replikácia fágovej DNA: a) hneď po infekcii bunky; b) excízia fágovej DNA z jadra po predchádzajúcom lyzogénnom cykle
- syntéza proteínov fágových hlavičiek a chvostíkov
- skladanie kompletných vírusových častíc a lýza buniek
Vektory odvodené od fágu lambda link
Do fágovej častice sa účinne vbaľuje DNA s veľkosťou 78-105% pôvodnej veľkosti λ-DNA, ktorá je ohraničená cos-miestami. Za účelom využitia fágu ako vektora boli odstránené restrikčné miesta a deletované nadbytočné gény (napr. gény pre lyzogéniu nie sú vôbec potrebné pre lytický cyklus), aby veľkosť rekombinantnej DNA mohla byť čo možno najväčšia.
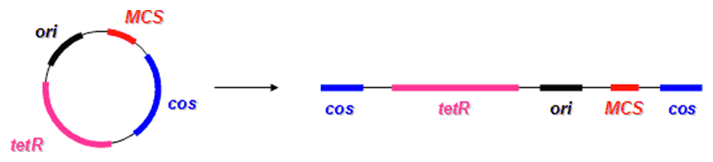
Istou modifikáciou vektorov odvodených od bakteriofágu λ sú tzv. kozmidy. Ako už názov napovedá, ide o plazmidy, ktoré obsahujú cos-miesta. Pri kozmidoch sa využil fakt, že na úspešné vbaľovanie DNA do fágovej častice sú potrebné len hraničné sekvencie (cos-miesta), pričom klonovacia kapacita takýchto vektorov je 35-50 kbp. Kozmidy teda obsahujú medzi cos-miestami počiatok replikácie (ori), selekčný marker a cudziu DNA, ale neobsahujú žiadne fágové gény, a preto sa na prenos tejto DNA do bunky síce využíva transdukcia (prenos pomocou fágov), ale ďalej sa táto DNA replikuje ako plazmidová DNA, pričom nedochádza ani k vzniku ďalších fágových častíc. Výhodou takéhoto systému je mnohonásobné zvýšenie počtu rekombinantov (transduktantov) oproti transformáciou vnesených plazmidových DNA, nehovoriac o väčšej kapacite kozmidov oproti klasickým plazmidovým vektorom.
Umelé chromozómy link
Umelé chromozómy sú klonovacie vektory, do ktorých možno vložiť veľké kusy cudzej DNA, pričom vzniknuté rekombinantné molekuly pripomínajú malé chromozómy.
Bakteriálne umelé chromozómy (BAC) link
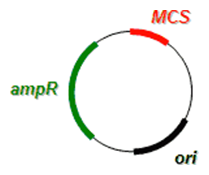
Bakteriálne umelé chromozómy, tzv. BACy (čítaj 'baky'; angl. bacterial artificial chromosomes) sú vhodné pre klonovanie DNA fragmentov veľkých až 300 kbp, ktoré sú schopné replikovať sa v E. coli. BACy obsahujú:
- Počiatok replikácie (ori) derivovaný z F plazmidu
- Polylinker
- Prokaryotický selekčný marker
Kvasinkové umelé chromozómy (YAC) link
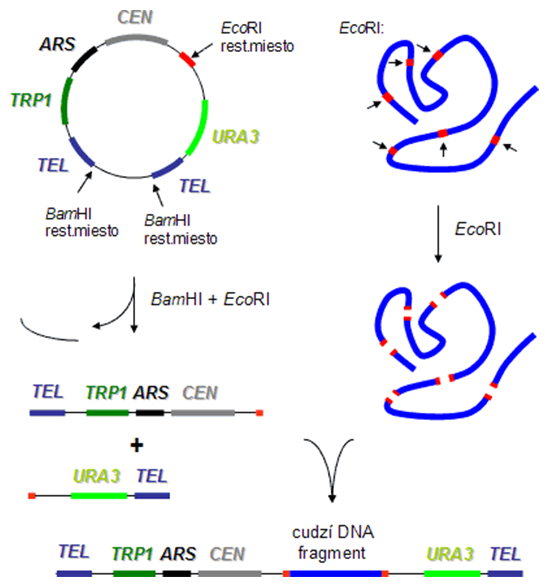
Kvasinkové umelé chromozómy, tzv. YACy (čítaj 'jaky'; angl. yeast artificial chromosomes) sú lineárne klonovacie vektory určené pre replikáciu v kvasinkách, schopné niesť cudziu DNA o veľkosti 0,2-2 Mbp. DNA veľkých YACov je však značne nestabilná, pretože často dochádza k prestavbám chromozómov (rekombinácie, translokácie), čo znemožňuje využitie týchto vektorov na mapovanie genómu organizmov, z ktorých analyzované cudzie fragmenty DNA pochádzajú. YACy majú trošku zložitejšiu štruktúru ako ostatné klonovacie vektory:
- Počiatok replikácie v hostiteľskom kvasinkovom organizme
- Dve kvasinkové teloméry na ochranu koncov lineárnych DNA umelých chromozómov
- Centroméra pre riadnu segregáciu vektorov počas mitózy
- Polylinker
- Dva rôzne eukaryotické selekčné markery (napr. TRP1 a URA3), každý pre jedno rameno umelého chromozómu
Najprv sa cirkulárny YAC vektor štiepi enzýmom BamHI, ktorý vyštiepi z molekuly krátky fragment DNA. Tým vznikne lineárny vektor zakončený na oboch stranách telomérami. Potom (alebo súčasne) sa štiepi YAC aj donorová DNA osobitne enzýmom EcoRI a výsledné produkty sa zmiešajú. Po transformácii auxotrofného kvasinkového kmeňa genotypu ura3 trp1 a selekcii transformantov na médiách bez uracilu a tryptofánu vyrastú len kolónie s kompletným YAC vektorom, tzn. vektorom s ľavým aj pravým ramenom. [ARS; angl. autonomously replicating sequence = počiatok replikácie u kvasiniek; CEN - centroméra; TEL - teloméra; TRP1 - gén pre syntézu tryptofánu; URA3 - gén pre syntézu uracilu]
Rastlinné vektory link
Tradičné šľachtenie rastlín sa opiera o kríženie odrôd so želanými vlastnosťami, pričom pre udržanie sa potrebných génov v novej odrode je nutné viacnásobné kríženie a postupná umelá selekcia najvyhovujúcejších genotypov. Okrem toho, že sa jedná o dlhodobý proces, je tradičné šľachtenie obmedzené väčšinou len na vnútrodruhové kríženie (ale nie vždy). Podobný princíp používali po stáročia aj šľachtitelia plemien psov, koní a ďalších úžitkových zvierat. V súčasnosti sa začínajú, najmä v rastlinnej genetike pre tvorbu nových rastlinných odrôd, využívať aj rekombinantné DNA, pomocou ktorých je umožnený vysoko účinný transfer špecifických génov do rastlín za podstatne kratšie časové obdobie. Môže pritom ísť aj o prenos génov do rastlín z akýchkoľvek tzn. aj nepríbuzných organizmov (napr. baktérie, človek). Vtedy už hovoríme o syntéze geneticky modifikovaných (GM) rastlín.
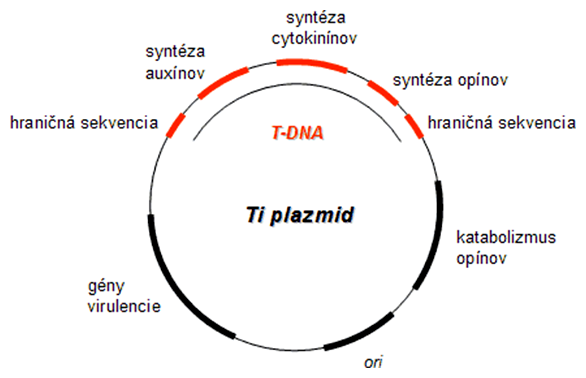
Transformácia rastlinných buniek je umožnená využitím prirodzeného infekčného mechanizmu pôdnej baktérie Agrobacterium tumefaciens. Baktéria infikuje rastlinu pomocou jej Ti plazmidu (angl. tumor-inducing) (cca 200 kbp). Z neho je po infekcii rastlinnej bunky "vystrihnutá" malá časť DNA (30 kbp), tzv. T-DNA (angl. transforming - transformujúca DNA), a jej gény sú zabudované do jadra hostiteľa procesom podobným bakteriálnej konjugácii. Agrobacterium využíva tento systém pre indukciu tvorby rastlinných nádorov, ktorých bunky syntetizujú špeciálne látky, tzv. opíny. Opíny potom spätne slúžia ako potrava pre baktérie, ktoré rastlina syntetizuje na svoje energetické náklady.
Pre úspešný transfer cudzej DNA do rastlín, prostredníctvom baktérie Agrobacterium, sa využil fakt, že pre samotný transfer sú potrebné len určité krátke 25 bp koncové sekvencie z T-DNA. Všetka DNA medzi týmito dvoma miestami je tým pádom vložená do rastlinnej DNA. Takto vzniklo mnoho rôznych transformačných systémov s rekombinantným Ti plazmidom a T-DNA.
Limitom tohto systému je neschopnosť baktérie Agrobacterium tumefaciens infikovať jednoklíčnolistové rastliny. Nimi je bohužiaľ väčšina hospodársky významných rastlín (kukurica, raž, pšenica, jačmeň, ovos). Výhodou rastlinných buniek je však ich jednoduché klonovanie, takže z dospelej rastliny možno vyňať kus pletiva, bunky použitím rastlinných hormónov dediferencovať (previesť ich na štádium analogické zygote po oplodnení), preniesť do ich buniek cudziu DNA a indukovať u transformovaných buniek pomocou hormónov diferenciáciu, po ktorej vyrastie nová dospelá rastlina.