Autor: Peter Pančík
Publikované dňa:
Citácia: PANČÍK, Peter. 2016. Biopedia.sk: Sekvenovanie DNA. [cit. 2024-04-26]. Dostupné na internete: <https://biopedia.sk/molekularna-biologia/sekvenovanie-dna>.
Pod pojmom sekvenovanie DNA rozumieme určenie primárnej štruktúry, t.j. určenie poradia nukleotidov v reťazci DNA (sekvencie DNA). Znalosť genetickej informácie je nevyhnutným predpokladom výskumu v mnohých oblastiach súčasnej biológie, pretože umožňuje porozumieť molekulárnej podstate biologických procesov. Na základe znalosti sekvencie DNA je možné odvodiť sekvencie RNA a aminokyselinové sekvencie proteínov kódovaných daným úsekom DNA. Zároveň postupy sekvenovania DNA sú po experimentálnej stránke podstatne jednoduchšie a lacnejšie ako sekvenovanie RNA alebo proteínov.
V praxi sa okrem štandardných označení nukleotidov (A, C, T, G, U) stretávame aj s písmenkami, ktoré vyjadrujú určitú nejednoznačnosť na danej pozícii v reťazci. Najčastejšie je to následok chybného merania. Toto označenie stanovuje Medzinárodná únia pre čistú a aplikovanú chémiu (IUPAC) nasledovne:
| A | adenín |
| C | cytozín |
| G | guanín |
| T | tymín |
| U | uracil |
| R | A alebo G (purín) |
| Y | C alebo T (alebo U) (pyrimidín) |
| S | G alebo C |
| W | A alebo T |
| K | G alebo T |
| M | A alebo C |
| B | C alebo G alebo T |
| D | A alebo G alebo T |
| H | A alebo C alebo T |
| V | A alebo C alebo G |
| N | ľubovoľná báza |
| . alebo - | prázdne miesto (medzera) |
Začiatky sekvenovania DNA siahajú do roku 1977, kedy boli uverejnené nezávisle na sebe dvomi tímami dve odlišné metódy sekvenovania:
- chemická metóda Maxama a Gilberta
- enzymatická metóda Sangera
Obidve metódy majú principiálne znaky rovnaké:
- vytvorí sa súbor molekúl DNA s rôznou veľkosťou, ktoré sú zakončené konkrétnou bázou
- tieto molekuly sa separujú elektroforeticky na géloch s rozlišovacou schopnosťou 1 nukleotid
Keďže menšie molekuly DNA migrujú v géli rýchlejšie, gél sa "číta" zo vzdialenejšieho miesta od jamiek smerom hore.
Chemická metóda link
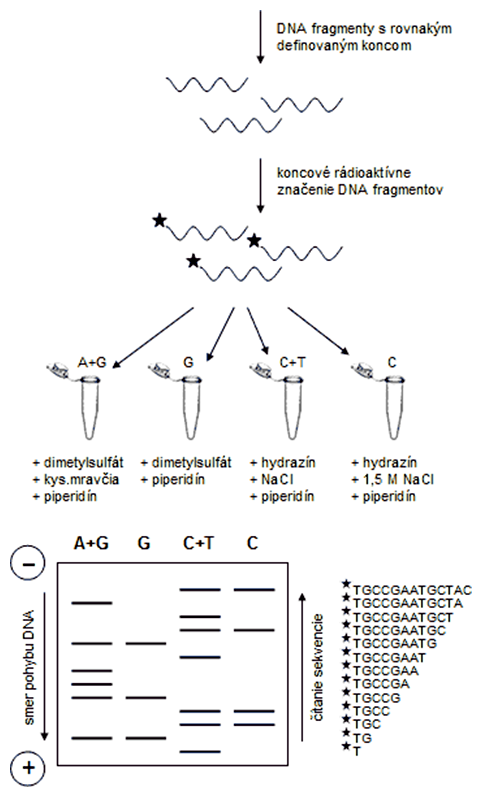
Priekopníci tejto metódy sú WALTER GILBERT (nar. 1932) a jeho študent ALLAN MAXAM (nar. 1942). Princípom metódy je rádioaktívne označenie molekuly DNA na 5'-konci a jej následná chemická modifikácia, ktorá je špecifická pre jednotlivé bázy. Následne sa v týchto modifikovaných miestach DNA chemicky štiepi, čím vzniknú rôzne dlhé fragmenty. Dodržiavajú sa pritom také podmienky, aby sa každá molekula DNA štiepila v priemere len na jednom mieste. Z každej molekuly DNA teda vzniknú 2 fragmenty: prvý je na 5'-konci rádioaktívne značený a na 3'-konci zakončený definovaným nukleotidom (podľa spôsobu použitej chemickej modifikácie), druhý fragment, keďže nie je rádioaktívne značený, nebude po autorádiografickej vizualizácii vôbec viditeľný a nebude prekážať sekvenačnej analýze.
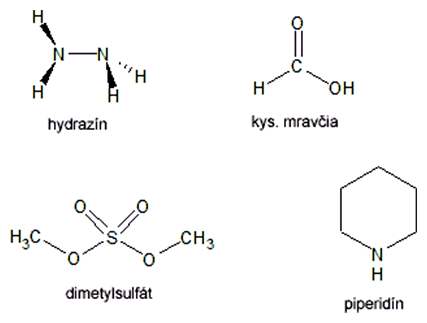
Purínové bázy (A, G) sa modifikujú dimetylsulfátom. Ak sa reakcia robí v prítomnosti kyseliny mravčej, sú modifikované oba purínové nukleotidy (A+G), bez jej prítomnosti reaguje len guanín. Modifikácia pyrimidínov (C, T) sa robí hydrazínom. Ak sa reakcia robí pri vysokej koncentrácii NaCl, modifikovaný je len cytozín, pri nízkej koncentrácii soli reagujú obe pyrimidínové bázy (C+T).
Jednotlivé zmesi modifikovej DNA sa opracujú piperidínom, a za týchto podmienok sa molekuly štiepia v mieste modifikácie. V každej skúmavke tak vznikne populácia DNA fragmentov s rôznou dĺžkou, ktoré sú však zakončené rovnakým nukleotidom alebo jedným z dvoch možných v prípade A+G a C+T.
| A + G | dimetylsulfát + kys.mravčia + piperidín |
| G | dimetylsulfát + piperidín |
| C + T | hydrazín + NaCl + piperidín |
| C | hydrazín + 1,5 M NaCl + piperidín |
Poštiepená DNA sa separuje elektroforeticky na polyakrylamidovom géli a vizualizuje autorádiograficky (podobne ako pri Southernovej hybridizácii). Kapacita reakcie v rámci jedného pracovného cyklu a následná elektroforéza umožňuje čítanie nukleotidovej sekvencie o dĺžke 200-300 nukleotidov.
Enzymatická metóda link
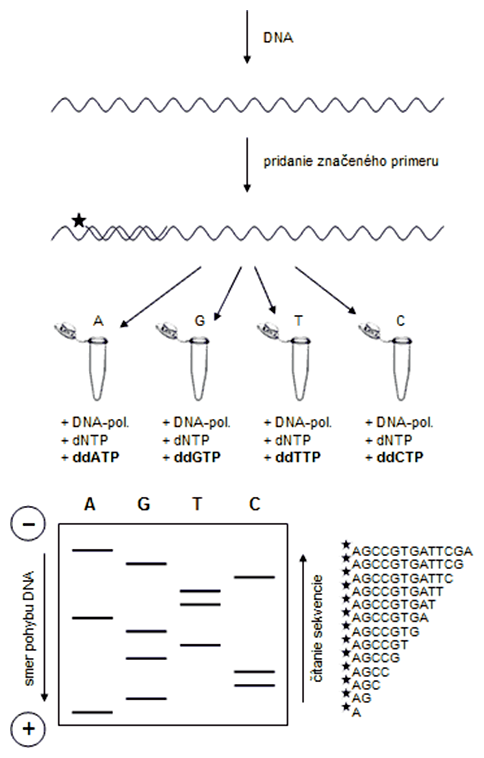
Objaviteľom enzymatickej metódy sekvenovania DNA je FREDERICK SANGER (1918-2013). Spolu s Gilbertom dostali Nobelovu cenu za chémiu v r. 1980. Sangerova metóda je známa aj pod názvom "dideoxy sekvenovanie", pretože využíva modifikované nukleotidy - dideoxy-nukleotidy (2',3'-dideoxyribonukleozidtrifosfáty), skrátene ddNTP. Tie sa od štandardných deoxy-nukleotidov (2'-deoxyribonukleozidtrifosfátov, skrátene dNTP) odlišujú tým, že sa môžu pripojiť do novovznikajúceho vlákna DNA na základe párovania báz (pretože majú funkčný 5'-koniec), ale po ich zabudovaní do DNA sa rast reťazca zastaví (nie je prítomný funkčný 3'-koniec).
Klasický postup Sangerovej metódy spočíva v syntéze protiľahlého reťazca DNA využitím rádioaktívne značeného primeru. Reakcia prebieha v štyroch skúmavkách, z ktorých v každej sa nachádzajú všetky štyri deoxy-nukleotidy (dNTP), ale pre každú skúmavku je špecifický malý prídavok určitého ddNTP (ddATP, ddCTP, ddTTP a ddGTP). Malé množstvo týchto dideoxy-nukleotidov spôsobí, že dochádza v prvom rade k začleňovaniu štandardných dNTP a len výnimočne ddNTP, ktorými sa zastavuje syntéza DNA reťazca. V konečnom dôsledku vznikne v každej skúmavke populácia rôzne veľkých DNA fragmentov zakončených konkrétnym ddNTP. Tieto fragmenty sa elektroforeticky separujú na polyakrylamidovom géli a vyhodnocujú podobne ako v prípade chemickej metódy sekvenovania DNA.
Neskoršie modifikácie Sangerovej enzymatickej metódy sekvenovania zahŕňajú predovšetkým nerádioaktívne (fluorescenčné) značenie DNA, a to buď primerov alebo jednotlivých ddNTP. Pri použití štyroch rôznych fluorofórov (jeden zvlášť pre každý typ ddNTP) sa môžu DNA fragmenty všetkých štyroch reakcií elektroforeticky separovať v spoločnej dráhe, pričom sa zo sekvenovania stáva rutinná záležitosť pod kontrolou počítačového softvéru automatických sekvenátorov.
Automatické sekvenátory link
Významným pokrokom pri rozvoji sekvenačných metód bolo zavedenie automatických sekvenátorov. Sú to prístroje na elektroforetickú separáciu a detekciu fragmentov DNA vznikajúcich Sangerovou metódou.
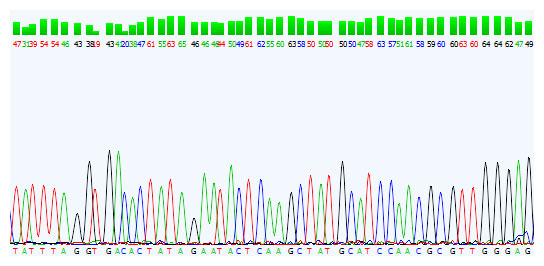
Prvé sekvenátory obsahovali klasický vertikálny polyakrylamidový gél, vzorky po rozdelení prechádzali v spodnej časti gélu detektorom, kde boli osvietené laserom a zaznamenala sa fluorescencia jednotlivých DNA fragmentov. Pri použití jednej fluorescenčnej značky pre všetky nukleotidy bolo potrebné separovať vzorky pre každý nukleotid v samostatných dráhach. Podstatným krokom k zjednodušeniu a zefektívneniu tejto technológie bolo zavedenie fluorescenčného značenia jednotlivých ddNTP, kedy každý typ ddNTP bol označený inou fluorescenčnou farbičkou, čo umožnilo spojiť do jednej skúmavky všetky štyri čiastkové sekvenačné reakcie.
Najnovšie automatické sekvenátory využívajú namiesto PAGE elektroforézu v tenkých kapilárach v lineárnych (tekutých) polyméroch, čím sa výrazne zvyšuje kapacita a zároveň sa znižujú požiadavky na technickú zručnosť ich obsluhy. Detekcia fluorescencie farbičiek prebieha po ich excitácii laserovým žiarením, následným zosnímaním emitovaného žiarenia kamerou a softvérovým spracovaním elektroforetogramu. Separácia fragmentov kapilárnou elektroforézou v lineárnych polyméroch umožňuje dosiahnuť čítanie nukleotidovej sekvencie o dĺžke 500-1200 nukleotidov v rámci jedného pracovného cyklu.
| organizmus *1 | poznámka | veľkosť genómu *2 | počet génov *3 |
| VIRA *4 | |||
| bakteriofág λ (lambda) *5 | dsDNA | 48 502 nt | ~28 prot. (65 génov *6) |
| bakteriofág M13 *7 | ssDNA | 6 407 nt | - |
| bakteriofág Mu *8 | dsDNA | 36 717 nt | ~28 prot. |
| bakteriofág P1 *9 | dsDNA | 93 601 nt | >117 génov |
| bakteriofág T4 *10 | dsDNA | 168 903 nt | 300 génov |
| bakteriofág T7 *11 | dsDNA | 39 937 nt | 30 prot. |
| HAdV-A sérotyp 12 | adenovirus A, dsDNA | 34 125 nt | 29 prot. |
| HBV (kmeň:ayr) | hepatitída B, retrovirus | 3 215 nt | 7 prot. |
| HIV-1 | retrovirus | 9 181 nt | 9 prot. |
| HIV-2 (izolát:BEN) | retrovirus | 10 359 nt | 9 prot. |
| HPV typ 1a | papilomavirus, dsDNA | 7 815 nt | 7 prot. |
| HSV-1 (kmeň:17) | herpes virus, dsDNA | 152 261 nt | 77 prot. |
| RSV | Rousov sarkóm, retrovirus | 9 392 nt | 4 prot. |
| SIV (izolát:677) | HIV opíc, retrovirus | 9 623 nt | 6 prot. |
| Vírus ovčích kiahní | varicella, dsDNA | 194 711 nt | 223 prot. |
| Vírus pravých kiahní (India-1967) | variola, dsDNA | 185 578 nt | 197 prot. |
| Vírus tabakovej mozaiky | ssDNA, 2 segm. | 5 085 nt | 7 prot. |
| PROKARYOTA *12 | |||
| Agrobacterium tumefaciens C58 | rast. parazit a vektor | 2 841 581 bp | 2 722 |
| Bacillus anthracis Ames | pôvodca antraxu | 5 227 293 bp | 5 311 |
| Bacillus subtilis 168 | model, nie je patogén | 4 214 630 bp | 4 106 |
| Bordetella pertussis Tohamal | čierny kašeľ | 4 086 189 bp | 3 806 |
| Borrelia burgdorferi B31 | lymská borelióza | 910 724 bp | 850 |
| Clostridium tetani E88 | tetanus | 2 799 251 bp | 2 373 |
| Corynebacterium diphtheriae NCTC13129 | záškrt | 2 488 635 bp | 2 320 |
| Escherichia coli K-12 | štand. kmeň E. coli | 4 639 675 bp | 4 331 |
| Helicobacter pylori 26695 | pôvodca žal.vredov | 1 667 867 bp | 1 566 |
| Lactobacillus acidophilus NCFM | zložka mlieka | 1 993 564 bp | 1 864 |
| Mycobacterium tuberculosis CDC1551 | pôvodca tuberkulózy | 4 403 837 bp | 4 189 |
| Mycoplasma genitalum G37 | najmenší prok. genóm | 580 076 bp | 476 |
| Pseudomonas aeruginosa PAO1 | nozokomiálne infekcie | 6 264 403 bp | 5 566 |
| Rhizobium leguminosarum viciae3841 | nitrifikačná baktéria | 7 751 309 bp | 4 746 |
| Salmonella typhimurium LT2 | pôvodca salmonelózy | 4 857 432 bp | 4 452 |
| Staphylococcus aureus COL | nozokomiálne infekcie | 2 809 422 bp | 2 673 |
| Treponema pallidum Nichols | syfilis | 1 138 011 bp | 1 031 |
| Vibrio cholerae N16961 | cholera | 2 961 149 bp | 2 736 |
| Yersinia pestis Antiqua | ľudský mor | 4 702 289 bp | 4 167 |
| EUKARYOTA *13 | |||
| Entamoeba histolytica | dyzentéria | 23,8 Mbp | 9 938 |
| Chlamydomonas reinhardtii | zelená riasa, model *14 | 121 Mbp | 15 400 |
| Paramecium tetraurelia | črievička, model | 72 Mbp | 39 642 |
| Plasmodium falciparum | malária | 23,1 Mbp | 5 878 |
| Tetrahymena termophila | riasničkavce, model | 104 Mbp | 27 000 |
| Trypanosoma brucei | spavá choroba | 26 Mbp | 9 068 |
| Aspergillus nidulans | model | 30 Mbp | 9 500 |
| Kluyveromyces lactis | kvasinka, model | 10-12 Mbp | 5 329 |
| Neurospora crassa | pleseň, model | 40 Mbp | 10 082 |
| Saccharomyces cerevisiae S288C | 1. osekv. euk., model | 12,1 Mbp | 6 294 |
| Schizosaccharomyces pombe 972h | kvasinka, model | 14 Mbp | 4 824 |
| Arabidopsis thaliana | kapustovité, model | 120 Mbp | 25 498 |
| Oryza sativa ssp. japonica | ryža, model | 466 Mbp | 46 022-55 615 |
| Vitis vinifera PN40024 | vinič | 490 Mbp | 30 434 |
| Apis mellifera | včela medonosná | 1,8 Gbp | 10 157 |
| Bombyx mori | priadka morušová | 530 Mbp | - |
| Caenorhabditis elegans Bristol N2 | červ, model | 97 Mbp | 19 000 |
| Drosophila melanogaster | mucha, model | 165 Mbp | 13 600 |
| Gallus gallus f. domestica *15 | kur domáci, model | 1,0 Gbp | 20-23 000 |
| Takifugu rubripes | ryba, najm. genóm stavovcov | 390 Mbp | 22-29 000 |
| Bos primigenius f. taurus *15 | krava | 3,0 Gbp | - |
| Canis lupus f. familiaris *15 | pes domáci | 2,4 Gbp | 19 300 |
| Cavia aperea f. porcellus *15 | morča | 3,4 Gbp | - |
| Equus przewalskii f. caballus *15 | kôň | 2,1 Gbp | - |
| Felis lybica f. catus *15 | mačka domáca | 3,0 Gbp | 20 285 |
| Homo sapiens | človek | 3,2 Gbp | 25 000 |
| Mus musculus var. alba *15 | myš, laboratórna | 2,5 Gbp | 24 174 |
| Pan troglodytes | šimpanz | 3,1 Gbp | - |
| Rattus norvegicus var. alba *15 | potkan, laboratórny | 2,8 Gbp | 21 166 |
Vysvetlivky:
*1 - u vírusov konkrétny typ/sérotyp/kmeň/izolát, ktorý bol osekvenovaný; druhový názov u prokaryot a niektorých eukaryot doplnený označením kmeňa (príp. odrody u rastlín)
*2 - u vírusov udávaná v nukleotidoch (nt), pri tomto údaji nerozhoduje, či sa jedná o dvoj- alebo jednovláknovú NK (uvedené v poznámkach); veľkosť genómu prokaryot a eukaryot udávaná v bp (bázových pároch), Mbp (1 000 000 bp) alebo Gbp (1 000 000 000 bp)
*3 - vírusy nemajú gény pre syntézu rRNA a tRNA, tak de facto je počet génov rovný počtu syntetizovaných proteínov (tento údaj o počte proteínov potom ale nezahŕňa prípadnú syntézu ostatných funkčných NK - napr. antisense RNA); u eukaryot je údaj o počte génov len približný!
*4 - zdroj: Entrez Genomes, Viral Genomes Resource
*5 - zdroj: Wikipedia, Lambda phage
*6 - spočítané všetky gény a orf neznámej funkcie z http://www.mun.ca/biochem/courses/4103/topics/Lambda/Lambda_overview.html
*7 - Simons, G.F.M., Konings, R.N.H., and Schoenmakers, J.G.G. (1981). Genes VI, VII, and IX of phage M13 code for minor capsid proteins of the virion. PNAS vol. 78, pp. 4194-4198.
*8 - Morgan, G.J., Hatfull, G.F., Casjens, S., and Hendrix, R.W. (2002). Bacteriophage Mu genome sequence: analysis and comparison with Mu-like prophages in Haemophilus, Neisseria and Deinococcus. Journal of Molecular Biology 317(3):337-59.
*9 - Lobocka, M.B., Rose, D.J., Plunkett, a kol. (2004). Genome of Bacteriophage P1. Journal of Bacteriology, vol. 186, no. 21, p. 7032-7068.
*10 - Miller, E.S., Kutter, E., Mosig, G., a kol. (2003). Bacteriophage T4 Genome. Microbiology and Molecular Biology Reviews, vol. 67, no. 1, p. 86-156.
*11 - Chan, L.Y., Kosuri, S., and Endy, D. (2005). Refactoring bacteriophage T7. Molecular Systems Biology 1 Article number: 2005.0018, doi:10.1038/msb4100025.
*12 - zdroj: Wikipedia, List of sequenced prokaryotic genomes (referencie uvedené tam)
*13 - zdroj: Wikipedia, List of sequenced eukaryotic genomes (referencie uvedené tam)
*14 - zdroj: Sandwalk: The Genome of Chlamydomonas reinhardtii
*15 - Gaisler, J., Zima, J.: Zoologie obratlovců. 2. prepracované vydanie, Academia, Praha 2007, 694 s., ISBN 978-80-200-1484-9.